یک مطالعه جدید نشان داده است که چگونه پروتئین های جهش یافته که نشانه بیماری پارکینسون هستند، در مغز پخش و جمع میشوند.
به گزارش تکناک، این یافته جدید مسیر را برای ایجاد راهی برای توقف پیشرفت این بیماری مخرب باز می کند و ممکن است در مقابله با سایر بیماری های عصبی ناشی از تجمع پروتئین مفید باشد.
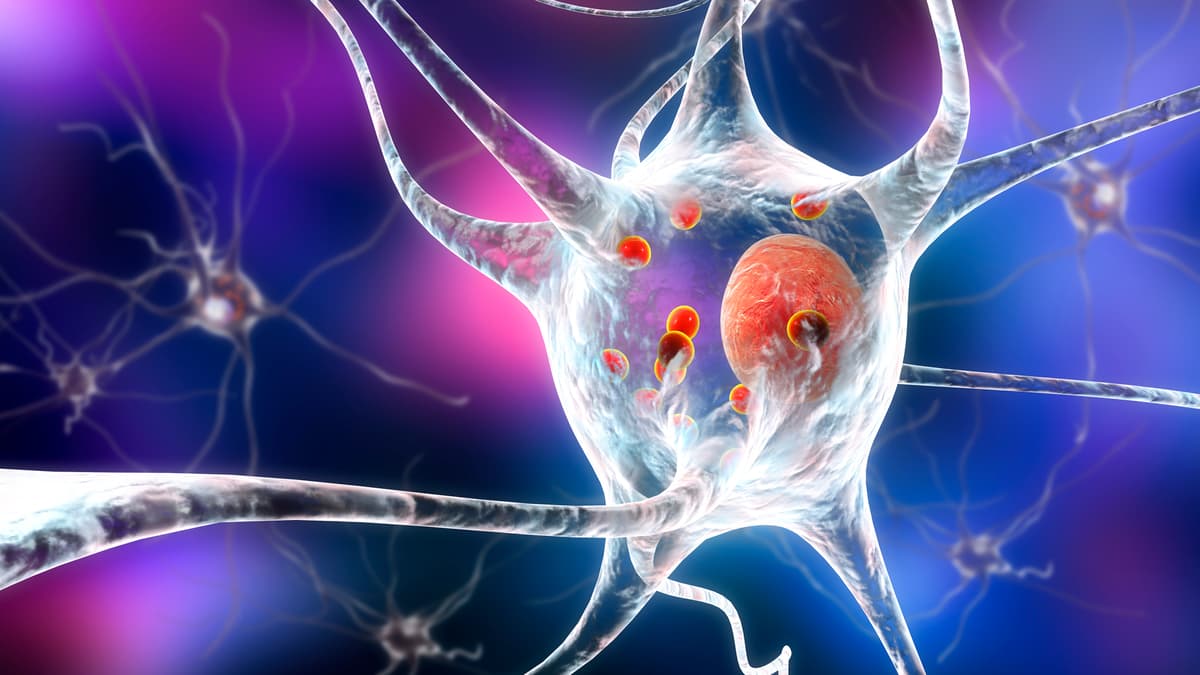
بیش از 20 سال پیش، پروتئین آلفا سینوکلئین کشف شد که نقش مهمی در ایجاد بیماری پارکینسون (PD) دارد. تصور میشود آلفا سینوکلئین های سمی و جهشیافته در کنار هم جمع میشوند و اجسام لوی را تشکیل میدهند که منجر به مرگ پیشرونده عصبی میشود. همچنین آلفا سینوکلئین در دومین شکل شایع زوال عقل پس از بیماری آلزایمر یعنی زوال عقل لووی نیز دخیل است.
تاکنون ارتباط بین اختلالات عصبی و تجمع و گسترش پروتئین هایی مانند آلفا سینوکلئین به خوبی مورد تحقیق قرار گرفته است. اما چیزی که نامشخص است این است که چه چیزی اول رخ می دهد: تجمع یا گسترش. یک مطالعه جدید توسط محققان دانشگاه پزشکی و دندانپزشکی Toyko پاسخ هایی را در این مورد ارائه کرده است.
کیوتا فوجیتا، نویسنده اصلی این مطالعه گفت: بیشتر آزمایشهایی که تاکنون انجام شدهاند فقط از فیبریلها استفاده میکردند که تودههایی هستند که هنگام تجمع آلفا سینوکلئین مونومر ایجاد میشوند. فیبریلها از نورون به نورون منتقل میشوند، اما مشخص نیست که آیا مونومرها نیز به همان شیوه عمل میکنند یا خیر.
محققان برای مشاهده نحوه حرکت مونومرها و فیبرهای آلفا سینوکلئین در اطراف مغز، مقدار کمی آلفا سینوکلئین جهش یافته را با یک پروتئین فلورسنت سبز به مغز موش تزریق کردند. از آنجایی که هر سلولی می تواند در گسترش آلفا سینوکلئین نقش داشته باشد، آنها از ذرات ویروسی برای فعال کردن سنتز آن در سلول های محل تزریق استفاده کردند.
دو هفته پس از تزریق، محققان متوجه فلورسانس در نواحی دورافتاده مغز، دور از محل تزریق شدند که این موضوع نشان میدهد آلفا سینوکلئین مونومر جهش یافته در حال گسترش است. آنها پروتئین فلورسنت را در سیستم گلیمفاتیک که آرایش منحصربهفردی از کانالها است که پروتئینها و متابولیتها را از سیستم عصبی مرکزی حذف میکند، یافتند و متوجه شدند که توسط نورونها جذب شده است. هنگامی که آنها 12 ماه دوباره بعد بررسی کردند، مونومرها به هم چسبیده بودند و فیبریل ها را تشکیل دادند.
هیتوشی اوکازاوا، نویسنده مسئول این مطالعه گفت: فیبرهای آلفا سینوکلئین پس از انتشار مونومرها تشکیل شدند. به طور خاص ما مونومر آلفا سینوکلئین را در سیستم گلیمفاتیک و مناطق دورافتادهف دو هفته پس از تزریق مشاهده کردیم، در حالی که فیبرهای آلفا سینوکلئین را 12 ماه پس از تزریق یافتیم.
محققان خاطرنشان کردند که میزان تجمع آلفا سینوکلئین و زمان تشکیل آن متفاوت بوده و متناسب با فاصله از محل تزریق نیست.
آنها می گویند این مطالعه درک بهتری از نحوه حرکت آلفا سینوکلئین در مغز ارائه می دهد و ممکن است برای هدف قرار دادن گسترش آن در اوایل توسعه بیماری پارکینسون مورد استفاده قرار گیرد و پیشرفت این بیماری را محدود کند. آنها می گویند این یافته ها را می توان به پروتئین های دیگری که باعث دیگر بیماری های عصبی می شوند تعمیم داد. این مطالعه در مجله Cell Reports منتشر شد.









![بنر تبلیغاتی با متن "XIAOMI EOL LIST [2026]" بر روی تصویری از ماژول دوربین گوشی هوشمند شیائومی.](https://technoc.ir/wp-content/uploads/2026/01/Xiaomi-to-stop-sending-software-updates-to-these-19-devices-in-2026-120x86.jpg)










