فهرست مطالب
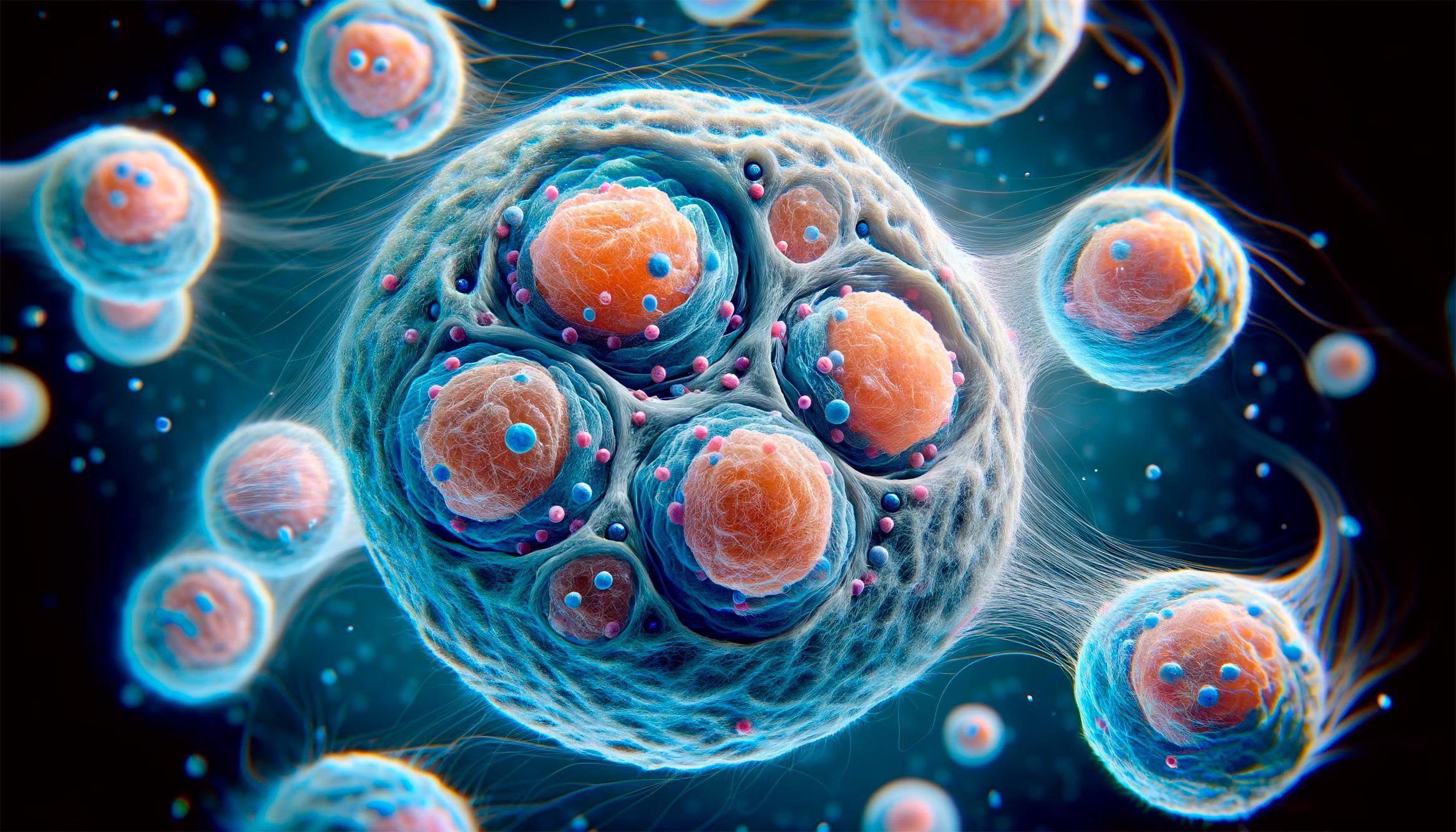
مطالعه جدید محققان دانشگاه MIT نشان می دهد که یک الگوی سه بعدی تاشو از ژنوم، کلید توانایی سلول ها برای ذخیره و انتقال خاطرات ژنتیکی است که باید فعال کنند.
به گزارش تکناک، هر سلول در بدن انسان حاوی دستورالعمل های ژنتیکی یکسانی است که در DNA آن رمزگذاری شده است. با این حال، از حدود 30000 ژن، هر سلول تنها ژن هایی را فعال می کند که برای تبدیل شدن به یک سلول عصبی، سلول ایمنی یا هر یک از صدها نوع سلول دیگر در بدن به آنها نیاز دارد.
سرنوشت هر سلول تا حد زیادی توسط تغییرات شیمیایی در پروتئین هایی که DNA آن را تزئین می کنند، تعیین میشود. این تغییرات به نوبه خود کنترل می کنند که کدام ژن روشن یا خاموش شود. با این حال، وقتی سلولها DNA خود را برای تقسیم کپی میکنند، نیمی از این تغییرات را از دست میدهند و این سوال باقی میماند: سلولها چگونه حافظه سلولی که قرار است باشند را حفظ میکنند؟
01
از 04الگوی ژنوم تاشو و حافظه سلولی
این مطالعه جدید MIT یک الگو نظری را پیشنهاد میکند که به توضیح چگونگی انتقال این خاطرات از نسلی به نسل دیگر هنگام تقسیم سلولها کمک میکند. محققان پیشنهاد میکنند که درون هسته هر سلول، ژنوم سه بعدی تاشو آن تعیین میکند که کدام بخش از ژنوم با این تغییرات شیمیایی مشخص میشود.
پس از اینکه یک سلول DNA خود را کپی می کند، علائم تا حدی از بین می روند، اما این ژنوم تاشو سه بعدی به سلول اجازه می دهد تا به راحتی علائم شیمیایی مورد نیاز برای حفظ هویت خود را بازیابی کند. هر بار که یک سلول تقسیم می شود، علائم شیمیایی به سلول اجازه می دهد تا ژنوم تاشوی سه بعدی خود را بازیابی کند. به این ترتیب، با جابجایی خاطرات ژنتیکی بین ژنوم تاشوی سه بعدی و علامت ها، می توان حافظه را در صدها تقسیم سلولی حفظ کرد.
یکی از جنبه های کلیدی تفاوت انواع سلول ها این است که ژن های مختلف روشن یا خاموش می شوند. تبدیل یک نوع سلول به نوع دیگر بسیار دشوار است زیرا این حالتها بسیار متعهد هستند.
محققان میگویند: کاری که ما در این تحقیق انجام دادهایم، توسعه یک الگوی ساده است که ویژگیهای کیفی سیستمهای شیمیایی درون سلولها و چگونگی کارکرد آنها برای پایدار کردن خاطرات ژنتیکی را برجسته میکند.
لئونید میرنی، نویسنده ارشد این مقاله است که اخیراً در مجله Science منتشر شده است.
02
از 04حفظ حافظه اپی ژنتیک
درون هسته سلول، DNA در اطراف پروتئین هایی به نام هیستون پیچیده می شود و ساختاری متراکم به نام کروماتین را تشکیل می دهد. هیستون ها می توانند تغییرات مختلفی را نشان دهند که به کنترل اینکه کدام ژن در یک سلول خاص فعال می شود، کمک می کند. این تغییرات، حافظه اپی ژنتیک را تولید میکنند که به سلول کمک میکند تا نوع سلولی خود را حفظ کند. با این حال، چگونگی انتقال این خاطره به سلول های دختر تا حدودی یک راز است.
تحقیق قبلی آزمایشگاه میرنی نشان داده است که ساختار سه بعدی کروموزوم ها تا حد زیادی توسط این تغییرات یا علائم اپی ژنتیک تعیین می شود. به طور خاص، محققان به این نتیجه رسیدند که یک سری مناطق کروماتین خاص، با علائمی که به سلول ها می گوید که بخش خاصی از DNA را نخوانند، یکدیگر را جذب می کنند و توده های متراکمی به نام هتروکروماتین را تشکیل می دهند که دسترسی به آنها برای سلول دشوار است.
میرنی و همکارانش در مطالعه جدید خود می خواستند به این سوال پاسخ دهند که چگونه این علائم اپی ژنتیک از نسلی به نسل دیگر حفظ می شود. آنها یک الگو محاسباتی از یک پلیمر با چند ناحیه مشخص شده ایجاد کردند و دیدند که این نواحی مشخص شده در یکدیگر فرو می ریزند و یک توده متراکم را تشکیل می دهند. سپس بررسی کردند که چگونه این نمرات از بین می رود و به دست می آید.
هنگامی که یک سلول DNA خود را برای تقسیم بین دو سلول دختر کپی می کند، هر کپی تقریباً نیمی از علائم اپی ژنتیک را دریافت می کند. سپس سلول باید علائم از دست رفته را قبل از اینکه DNA به سلولهای دختر منتقل شود، بازیابی کند و روش تا شدن کروموزومها به عنوان طرحی برای اینکه این علائم باقیمانده باید کجا بروند، عمل میکند.
این تغییرات توسط آنزیمهای تخصصی به نام آنزیمهای خواننده-نویسنده اضافه میشوند. هر یک از این آنزیم ها برای یک علامت خاص هستند، و هنگامی که آنها علائم موجود را میخوانند، علائم اضافی را در مکان های نزدیک می نویسند. اگر کروماتین قبلاً به شکل سه بعدی تا شده باشد، علائم در مناطقی جمع می شود که قبلاً تغییراتی از سلول والد به ارث رسیده است.
شواهد متعددی وجود دارد که نشان میدهد انتشار میتواند به صورت سهبعدی اتفاق بیفتد، به این معنی که اگر دو بخش در نزدیکی یکدیگر در فضا وجود داشته باشند، حتی اگر در امتداد DNA مجاور نباشند، پس انتشار میتواند از یکی به دیگری اتفاق بیفتد. به این ترتیب ساختار سه بعدی می تواند بر گسترش این علائم تأثیر بگذارد.
این فرآیند مشابه گسترش بیماری عفونی است، زیرا هرچه تماس های یک ناحیه کروماتین با سایر نواحی بیشتر باشد، احتمال تغییر آن بیشتر می شود، همانطور که با افزایش تعداد تماس ها، احتمال ابتلای فرد به بیماری بیشتر است. در این قیاس، مناطق متراکم کروماتین مشخص مانند شهرهایی هستند که افراد در آن تعاملات اجتماعی زیادی دارند، در حالی که بقیه ژنوم با مناطق روستایی کم جمعیت قابل مقایسه است.
میرنی میگوید: این اساساً به این معنی است که نشانهها در منطقه متراکم پخش میشوند و در هر نقطه خارج از آن بسیار پراکنده خواهند بود.
03
از 04حافظه اپی ژنتیک و پردازش اطلاعات
این الگوی جدید شباهتهای احتمالی بین خاطرات اپی ژنتیکی ذخیرهشده در یک پلیمر تا شده و حافظههای ذخیرهشده در یک شبکه عصبی را پیشنهاد میکند. چینخوردگی نواحی مشخصشده را میتوان شبیه به اتصالات قوی ایجاد شده بین نورونهایی دانست که در یک شبکه عصبی با هم شلیک میشوند.
به طور کلی این الگو نشان میدهد که شبیه به روشی که شبکههای عصبی قادر به پردازش اطلاعات بسیار پیچیده هستند، مکانیسم حافظه اپی ژنتیکی ممکن است بتواند اطلاعات را پردازش کند، نه فقط آنها را ذخیره کند.
04
از 04فرسایش اپی ژنتیک
در حالی که به نظر می رسد این الگو توضیح خوبی برای چگونگی حفظ حافظه اپی ژنتیک ارائه می دهد، محققان به این نتیجه رسیدند که در نهایت، فعالیت آنزیم خواننده-نویسنده منجر به پوشاندن کل ژنوم در تغییرات اپی ژنتیکی می شود. وقتی آنها الگو را تغییر دادند تا آنزیم ضعیفتر شود، به اندازه کافی ژنوم را پوشش نداد و خاطرات در چند نسل سلولی از بین رفت.
برای اینکه این الگو با دقت بیشتری در مورد حفظ علائم اپی ژنتیکی توضیح دهد، محققان عنصر دیگری را اضافه کردند: محدود کردن مقدار آنزیم خواننده-نویسنده در دسترس. آنها به این نتیجه رسیدند که اگر مقدار آنزیم بین 0.1 تا 1 درصد از تعداد هیستون ها (درصدی بر اساس برآورد فراوانی واقعی این آنزیم ها) حفظ شود، سلول های الگوی آنها می توانند بسته به پیچیدگی الگوی اپی ژنتیکی، حافظه اپی ژنتیک خود را تا صدها نسل با دقت حفظ کنند.
سلول ها با افزایش سن شروع به از دست دادن حافظه اپی ژنتیک خود می کنند و اکنون محققان قصد دارند بررسی کنند که آیا فرآیندی که در این مقاله توضیح داده اند، ممکن است در فرسایش اپی ژنتیک و از دست دادن هویت سلولی نقش داشته باشد یا خیر. آنها همچنین قصد دارند بیماری به نام پروگریا را شبیهسازی کنند که در آن سلول ها دارای جهش ژنتیکی هستند که منجر به از دست دادن هتروکروماتین می شود. افراد مبتلا به این بیماری پیری سریع را تجربه می کنند.
اوون میگوید: ارتباط مکانیکی بین این جهشها و تغییرات اپی ژنتیکی که در نهایت رخ میدهند به خوبی درک نشده است.