مطالعه جدید پتانسیل یادگیری ماشینی را برای سرعت بخشیدن به توسعه فناوری های نوآورانه در فرمولاسیون دارو نشان می دهد.
به گزارش تکناک، دانشمندان دانشگاه تورنتو با موفقیت استفاده از نمونه های یادگیری ماشینی را برای هدایت طراحی فرمولهای دارویی تزریقی طولانیاثر،آزمایش کردند.
پتانسیل الگوریتمهای یادگیری ماشینی برای تسریع فرمولبندی دارو میتواند زمان و هزینه مرتبط با توسعه دارو را کاهش دهد و داروهای جدید امیدوارکننده را سریعتر در دسترس قرار دهد.
این مطالعه در مجله Nature Communications منتشر شد و یکی از اولین مطالعاتی است که از تکنیک های یادگیری ماشینی در طراحی فرمولاسیون داروهای تزریقی پلیمری طولانی اثر استفاده می کند.
این تحقیقات چند رشته ای توسط کریستین آلن از دپارتمان علوم دارویی دانشگاه تورنتو و آلان آسپورو از دپارتمان های شیمی و علوم کامپیوتر رهبری می شود.همچنین هر دوی این محققان عضو کنسرسیوم شتاب هستند که یک ابتکار جهانی است که از هوش مصنوعی و اتوماسیون برای تسریع در کشف مواد و مولکول های مورد نیاز برای آینده استفاده می کند.
کریستین آلن، استاد علوم دارویی در دانشکده داروسازی لزلی دان در دانشگاه تورنتو، گفت:این مطالعه گامی حیاتی در جهت توسعه فرمول دارویی مبتنی بر اطلاعات بدست آمده با تاکید بر تزریقی های طولانی اثر برمی دارد. ما دیدهایم که چگونه یادگیری ماشینی پیشرفتهای جهشی باورنکردنی را در کشف مولکولهای جدیدی که پتانسیل تبدیل شدن به دارو را دارند،ممکن کرده است.ما اکنون در حال کار بر روی استفاده از تکنیکهای مشابه برای کمک به طراحی فرمولهای دارویی بهتر و در نهایت تولید داروهای موثر هستیم.»
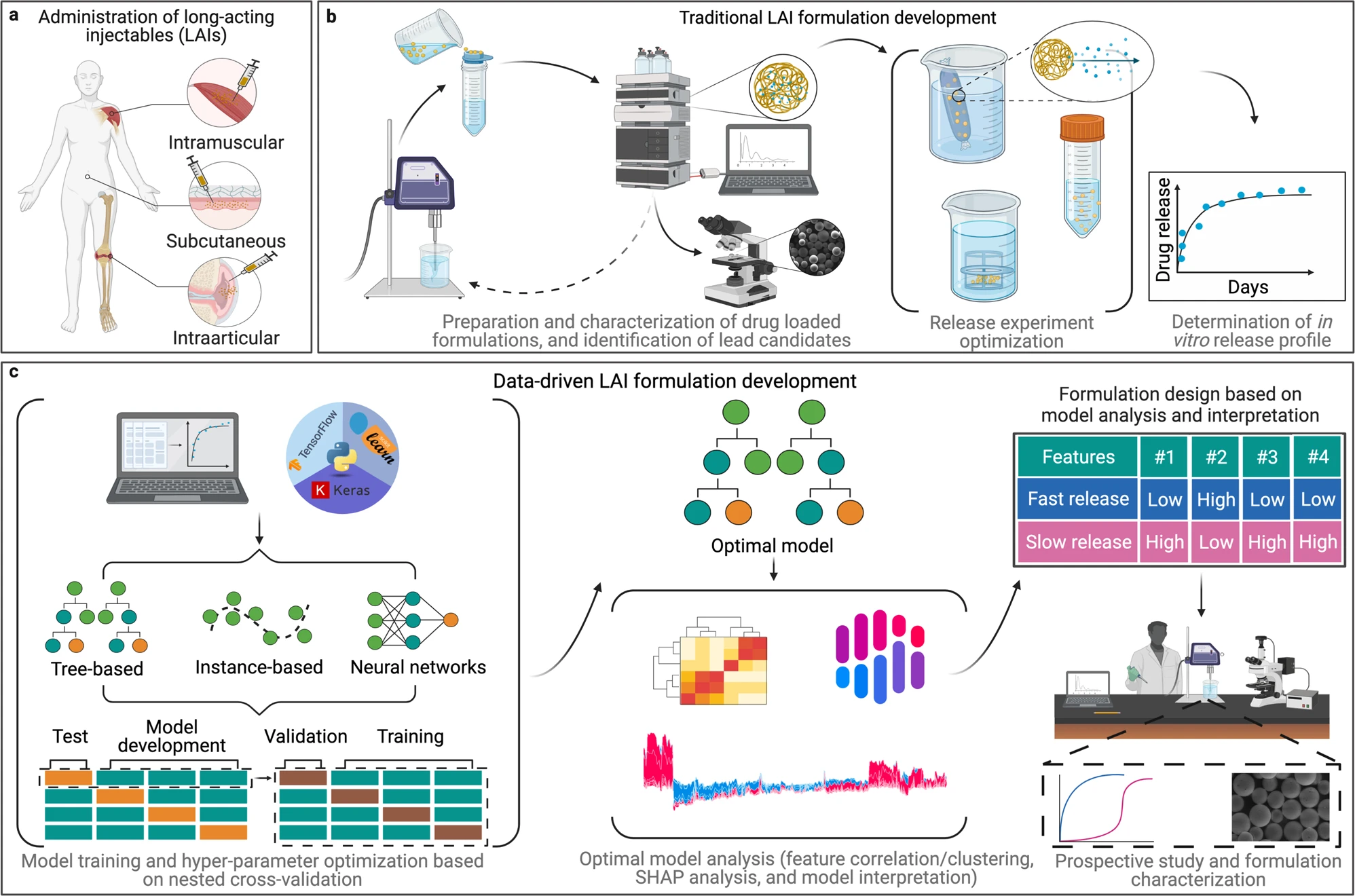
داروهای تزریقی طولانیاثر (LAI) که یکی از امیدوارکنندهترین استراتژیهای درمانی برای درمان بیماریهای مزمن در نظر گرفته میشوند،دستهای از سیستمهای دارورسانی پیشرفته هستند که برای آزادسازی محمولههای خود در مدت زمان طولانی برای دستیابی به اثر درمانی طولانیمدت طراحی شدهاند.
این رویکرد می تواند به بیماران کمک کند تا بهتر به رژیم دارویی خود پایبند بمانند، عوارض جانبی را کاهش دهند و اثربخشی را در هنگام تزریق در نزدیکی محل اثر در بدن افزایش دهند. با این حال، دستیابی به مقدار بهینه تاثیر دارو در طول دوره زمانی مورد نظر،مستلزم توسعه و شناسایی طیف وسیعی از فرمولاسیون های کاندید از طریق آزمایشهای گسترده و زمانبر است. این رویکرد آزمون و خطا در مقایسه با انواع مرسوم تر فرمولاسیون دارویی، نکته قابل توجهی در توسعه LAI ایجاد کرده است.
آلان آسپورو گوزیک ، استاد شیمی و علوم کامپیوتر دانشگاه تورنتو گفت: هوش مصنوعی روش های علمی ما را متحول می کند.این موضوع به تسریع کشف و بهینه سازی عملکردی داروها کمک می کند.این رویکرد یک مثال کامل از دوره “قبل از هوش مصنوعی” و “پس از هوش مصنوعی” است و نشان می دهد که چگونه تحویل دارو می تواند تحت تأثیر این تحقیقات چند رشته ای قرار گیرد.
برای بررسی اینکه آیا ابزارهای یادگیری ماشینی می توانند به طور دقیق میزان انتشار دارو را پیش بینی کنند، تیم تحقیقاتی یک مجموعه یازده نمونه ای مختلف را آموزش و ارزیابی کردند.مجموعه داده های مورد استفاده برای آموزش،از مجموعه منتخب مدل های یادگیری ماشینی از مطالعات منتشر شده قبلی توسط نویسندگان و سایر گروه های تحقیقاتی ساخته شده است.
پائوریک بانیگان،همکار پژوهشی گروه تحقیقاتی آلن در دانشکده داروسازی لزلی دان دانشگاه تورنتو، گفت: هنگامی که اطلاعات را بدست آوردیم،آن را به دو زیر مجموعه تقسیم کردیم، یکی برای آموزش نمونه ها و دیگری برای آزمایش.سپس از نمونه ها خواستیم تا نتایج مجموعه آزمون را پیشبینی کرده و مستقیماً با دادههای تجربی قبلی مقایسه کنند.ما متوجه شدیم که مدل lightGBM، دقیقترین پیشبینیها را ارائه میکند.
به عنوان گام بعدی،تیم برای اعمال این پیشبینیها و نشان دادن چگونگی استفاده از نمونه های یادگیری ماشینی برای اطلاعرسانی در طراحی LAIهای جدید کار کرد.تیم تحقیقاتی از تکنیکهای تحلیلی پیشرفته برای استخراج معیارهای طراحی از مدل lightGBM استفاده کرد. این مسئه امکان طراحی یک فرمول LAI جدید برای دارویی که در حال حاضر برای درمان سرطان تخمدان استفاده می شود را فراهم کرد.
بانیگان گفت: وقتی یک نمونه آموزشدیده دارید، میتوانید آنچه را که ماشین آموخته است تفسیر کنید و از آن برای توسعه معیارهای طراحی برای سیستمهای جدید استفاده کنید. پس از آماده سازی، نرخ رهاسازی دارو مورد آزمایش قرار گرفت و پیش بینی های انجام شده توسط مدل lightGBM بیشتر تایید شد. مطمئناً، این فرمول جدید میزان انتشار آهسته ای داشت که ما به دنبال آن بودیم.این مسئله مهم بود زیرا در گذشته ممکن بود چندین بار تکرار شود تا به نمایهای شبیه به این نسخه که با یادگیری ماشینی به آن رسیدیم ،برسیم.
نتایج مطالعه کنونی دلگرمکننده است و نشاندهنده پتانسیل یادگیری ماشینی برای کاهش اتکا به آزمایشهای آزمون و خطا است که سرعت توسعه را برای تزریقهای طولانی اثر کاهش میدهد.با این حال، نویسندگان این مطالعه تشخیص می دهند که فقدان مجموعه داده های منبع باز در دسترس در علوم دارویی، چالشی مهم برای پیشرفت های آینده است.
آلن گفت: زمانی که این پروژه را آغاز کردیم، از نبود اطلاعات گزارش شده در مطالعات متعدد با استفاده از میکروذرات پلیمری، شگفت زده شدیم. آلن میگوید: این بدان معناست که مطالعات و کارهای انجام شده برای آنها نمیتواند برای توسعه مدلهای یادگیری ماشینی که برای پیشبرد پیشرفتها در این فضا نیاز داریم، استفاده شود. او گفت: یک نیاز واقعی برای ایجاد پایگاههای اطلاعاتی قوی در علوم دارویی وجود دارد که دسترسی آزاد و در دسترس همگان باشد تا بتوانیم همه با هم برای پیشبرد این زمینه کار کنیم.
آلن و تیم تحقیقاتی اش برای ارتقای حرکت به سمت پایگاههای اطلاعاتی در دسترس مورد نیاز برای حمایت از ادغام یادگیری ماشینی در علوم دارویی به طور گستردهتر، مجموعه اطلاعات و کدهای خود را در پلتفرم منبع باز Zenodo در دسترس عموم قرار دادهاند.
بانیگان گفت:در این مطالعه هدف ما کاهش موانع ورودی به استفاده از یادگیری ماشینی در علوم دارویی بود. ما مجموعه دادههای خود را بهطور کامل در دسترس قرار دادهایم، بنابراین دیگران میتوانند امیدوار باشند این کار واقعا جواب می دهد.ما می خواهیم این مسئله شروع کننده چیزی باشد،نه پایان داستان یادگیری ماشینی در فرمولاسیون دارو.
















![بنر تبلیغاتی با متن "XIAOMI EOL LIST [2026]" بر روی تصویری از ماژول دوربین گوشی هوشمند شیائومی.](https://technoc.ir/wp-content/uploads/2026/01/Xiaomi-to-stop-sending-software-updates-to-these-19-devices-in-2026-120x86.jpg)




