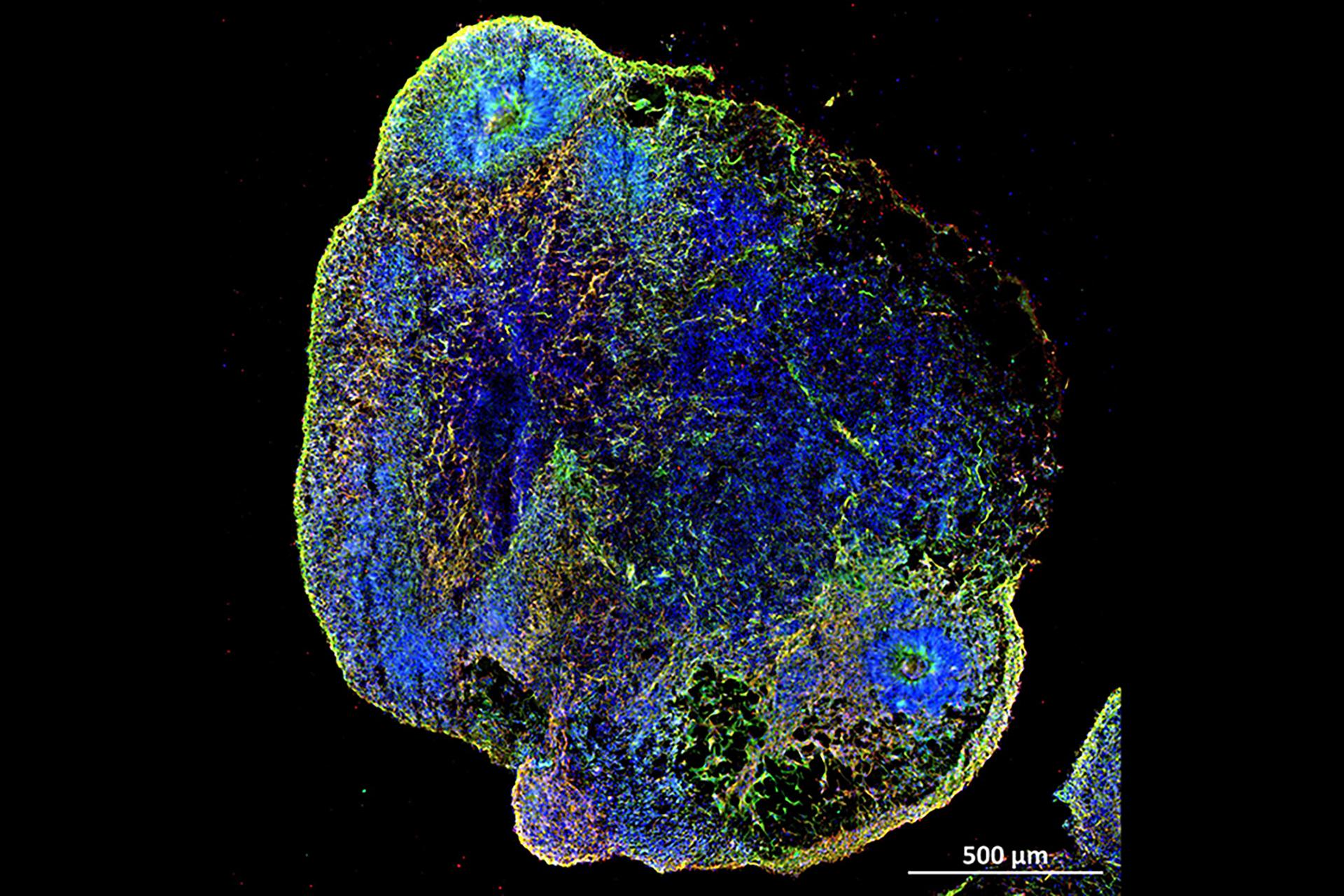
محققان با آزمایش بر روی مغزهای کوچک و موش های آزمایشگاهی به این نتیجه رسیدند که کووید 19 می تواند باعث تجمع سلول های زامبی شود و به مه مغزی مرتبط با کووید طولانی کمک کند و داروهایی را شناسایی کرده اند که می توانند آسیب مغزی مربوط به این ویروس را از بین ببرند.
به گزارش تکناک، اگرچه در درجه اول ویروس SARS-CoV-2 یک پاتوژن ویروسی تنفسی است، اما طیف وسیعی از عوارض عصبی را ایجاد می کند. کووید طولانی اغلب با اختلالات ذهنی یا مه مغزی همراه است که یکی از عوارض قابل توجهی است که شواهد زیادی از تغییرات ساختاری قابل توجه در مغز بیماران مبتلا به کووید-19 را تأیید میکند.
در حالی که نقش سلولهای پیر یا زامبی یعنی سلولهایی که تقسیم خود را متوقف کردهاند، در ایجاد بیماریهای عصبی و کاهش عملکرد ذهن که در پیری مشاهده میشود، توسط تحقیقات پشتیبانی میشود، تاکنون سهم آنها در پیری مغز مرتبط با کووید ناشناخته بوده است.
این امر باعث شد تا محققان مؤسسه مهندسی زیستی و نانوتکنولوژی استرالیا (AIBN) دانشگاه کوئینزلند (UQ) تأثیر انواع مختلف SARS-CoV-2 را بر بافت مغز مطالعه کنند و به دنبال داروهایی بگردند که ممکن است این روند را از بین ببرند.
جولیو آگوادو، سرپرست و نویسنده مسئول این مطالعه گفت: ما به این نتیجه رسیدیم که کووید-19 حضور سلولهای زامبی یا پیری را تسریع میکند. سلول های زامبی سلولهایی هستند که بهطور طبیعی و تدریجی با افزایش سن در مغز جمع می شوند. سلولهای پیر میتوانند التهاب و انحطاط بافت را تحریک کنند و بیماران را در معرض آسیبهای ذهنی مانند مه مغزی و از دست دادن حافظه قرار دهند.

محققان فرض کردند که پیری ناشی از SARS-CoV-2 در مغز با اثرات عصبی التهابی ویروس در طول فاز حاد بیماری مرتبط است. آنها برای آزمایش فرضیه خود، مغز بیمارانی را که در پی کووید-19 شدید یا به دلایل غیرعفونی و غیرعصبی فوت کرده بودند، تجزیه و تحلیل کردند. آنها بیش از هفت برابر تعداد سلول های پروتئین p16 مثبت را در مغز بیمارانی که به کووید 19 مبتلا بودند، در مقایسه با گروه تحت کنترل پیدا کردند. پیری سلولی اغلب با فعالیت پروتئین p16 مشخص میشود و یافتهها، نقش SARS-CoV-2 را در تحریک پیری سلولی نشان میدهد که میتواند به زوال عقل کمک کند و فرآیندهای تخریب عصبی مرتبط با کووید طولانی را تسریع کند.
سپس محققان اندامک های مغزی که مغزهای ریز آزمایشگاهی هستند را از سلولهای بنیادی جنینی تولید کردند و این اندامک های مغزی را از نظر فیزیولوژیکی به مدت هشت ماه قبل از آزمایش اثربخشی سنولیتیکها یا داروهایی که سلولهای پیر را از بین میبرند، پیر کردند.
آگوادو گفت: ما از اندامک های مغزی برای غربالگری طیف وسیعی از درمانها استفاده کردیم و به دنبال هر چیزی بودیم که بتواند آن سلولهای پیر را از بین ببرد.
محققان چهار دارویی را شناسایی کردند که به طور انتخابی سلول های پیر را از بین می بردند که عبارتند از: نویتوکلاکس، ABT-737، fisetin و ترکیبی از dasatinib و quercetin (D+Q) و ABT-737 که پروتئین Bcl-2 را مهار می کنند که باعث آپوپتوز یا مرگ برنامه ریزی شده سلولی در سلول های پیر می شود. فیستین و D+Q از سد خونی مغزی عبور می کنند و سلول های پیر را از مغز پاک می کنند. ارگانوئیدهای مسن در معرض دو دوز (هر دو هفته یک بار) از هر دو نویتوکلاکس، ABT-737، یا D+Q قرار گرفتند و پس از آن تحت آنالیز توالی RNA حجیم قرار گرفتند.
در مقایسه با نویتوکلاکس و ABT-737، D+Q دارای طیف وسیع تری بود و مسیرهای پیش التهابی متعدد مشخصه پیری سلولی را کاهش می داد. علاوه بر عمل به عنوان یک سنولیتیک، درمان D+Q روی اندامک های نه ماهه، سن فعالیت ژن آنها را به سطوح قابل مقایسه با همتایان هشت ماهه خود بازگرداند.
تغییرات فعالیت ژن ناشی از درمان D+Q با ویژگیهای مداخلات افزایش طول عمر مانند محدودیت کالری همبستگی مثبت داشت که این موضوع نشاندهنده نقش ارتقاء سلامت دارو در هدف قرار دادن پیری سلولی است. به طور خلاصه، این درمان بافت مغزی اندامک ها را جوان کرد.
علاوه بر پیری طبیعی مغز، محققان اندامک های مغز را با انواع SARS-CoV-2 آلوده کردند و کشف کردند که این کار منجر به افزایش قابل توجهی در پیری سلولی، به ویژه نوع دلتا می شود. درمان اندامک های مغزی آلوده با سنولیتیک ها، کاهش قابل توجهی از فعالیت RNA ویروسی SARS-CoV-2 را نشان داد.
سپس محققان به آزمایش روی موشهای آلوده به نوع دلتا SARS-CoV-2 پرداختند. درمان با فیستین یا D+Q به طور قابلتوجهی بقای موشها را در مقایسه با گروه تحت کنترل بهبود بخشید و میانگین طول عمر این حیوانات را تا 60 درصد افزایش داد. تمام مداخلات سنولیتیک منجر به کاهش ویژگیهای مرتبط با کووید، به ویژه در گروه تحت درمان با D+Q، از جمله کاهش میزان پروتئین p16 و سیتوکینهای پیش التهابی شد.
همانند آزمایش روی اندامک ها، محققان کشف کردند که در موشهای تحت درمان با senolytics، فعالیت ژن ویروسی و ژن پیری به میزان قابل توجهی در مقایسه با موشهای درماننشده کاهش یافت.
آگوادو گفت: تحقیقات بیشتری برای درک کامل مکانیسم های موجود مورد نیاز است، اما این مطالعه یک گام مهم رو به جلو در دانش ما از رابطه پیچیده بین عفونت های ویروسی، پیری و سلامت عصبی است. میتوان انتظار استفاده گسترده از این داروها به منظور درمان عفونت های مداوم ناشی از ویروس هایی مانند ویروس کرونا داشت.
محققان می گویند استفاده از اندامک های مغزی آنها را قادر می سازد تا تحقیقاتی اخلاقی انجام دهند که انجام آنها عملاً در انسان ها دشوار است و همین روش می تواند برای مطالعه سایر بیماری های عصبی مرتبط با پیری مورد استفاده قرار گیرد.
ارنست ولوتانگ، یکی از نویسندگان این مطالعه گفت: مطالعه ما به زیبایی نشان میدهد که چگونه مدلهای مغز انسان میتوانند غربالگری پیش بالینی درمانها را تسریع کنند. همین روش غربالگری دارویی میتواند به تحقیقات حوزه آلزایمر و مجموعهای از بیماریهای تخریبکننده عصبی کمک کند که پیری عامل اصلی آن است.
این مطالعه در مجله Nature Aging منتشر شد.