به زودی درمان هدفمند و موثر بیماری مولتیپل اسکلروزیس (اماس) و حتی ترمیم اعصاب آسیب دیده ناشی از این بیماری، به لطف پیشرفتی جدید در زمینه تحقیقات دارویی مولکول های کوچک، به واقعیت تبدیل میشود.
به گزارش تکناک، محققان به سرپرستی گروهی در مرکز اعتیاد و سلامت روان کانادا (CAMH) کار خود را بر روی یک داروی مولکولی کوچک متمرکز کردهاند که گیرنده گلوتامات AMPA را هدف قرار میدهد و نتایج این مطالعه در رویکرد جدید آن برای درمان اماس نویدبخش است.
با آزمایش روی سه ترکیب جدید سنتز شده، توانایی یکی از آنها برجسته شد که اکنون به نام ZCAN262 شناخته می شود و هم علائم شبیه ام اس را کاهش می دهد و
هم در ترمیم میلین در دو حیوان متفاوت، امیدوارکننده است.
محقق اصلی این مطالعه به نام فانگ لیو، گفت: ترکیب ما تأثیر خیرهکنندهای در ترمیم میلین و عملکرد حرکتی در نمونههای آزمایشگاهی داشت و امیدوارم این اثرات در درمان انسانها نیز کاربردی باشند تا به درمانهای فعلی اضافه شود و امید جدیدی برای بیماران مبتلا به اماس رقم بزند.
بیماری ام اس که بیش از سه میلیون نفر در ایالات متحده را تحت تاثیر قرار می دهد، یک بیماری عصبی دژنراتیو است که دارای مجموعه وسیعی از علائم ناتوان کننده فزاینده از جمله کاهش هماهنگی و شناخت، ضعف عضلانی، بی اختیاری، افسردگی و فلج است.
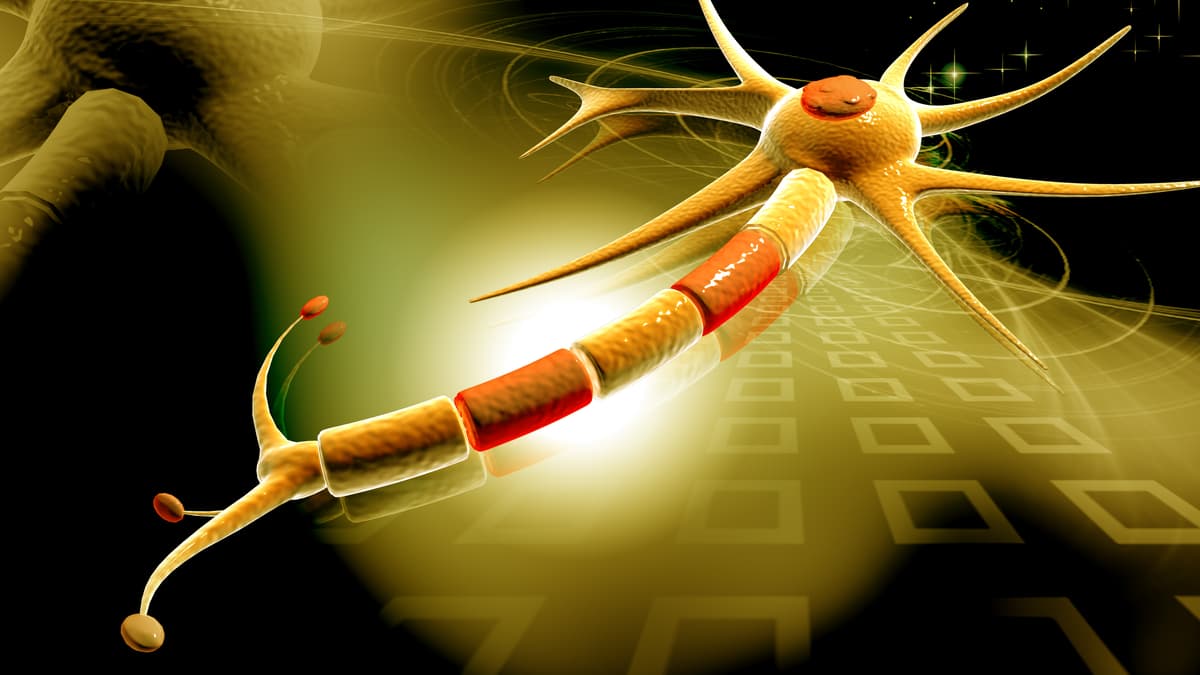
مکانیسم کلیدی این بیماری، فرسایش غلاف محافظ میلین است که اعصاب مغز و نخاع را احاطه کرده است. در حال حاضر، داروهای اماس سیستم ایمنی را هدف قرار می دهند تا با التهاب ناشی از این بیماری مقابله کنند که گمان می رود محرک تخریب میلین باشد.
محققان این مطالعه خاطرنشان کردند: اماس بهطور سنتی بهعنوان یک اختلال خود ایمنی در نظر گرفته میشود که در آن سلولهای CD4+ T میلین را هدف قرار میدهند که منجر به التهاب میشود و باعث دمیلیناسیون و شکلگیری ضایعات ماده سفید در سراسر سیستم عصبی میشود. با خودایمنی به عنوان پاتوفیزیولوژی مفروض ام اس، توسعه درمان های ام اس بر تعدیل سیستم ایمنی متمرکز شده است.
محققان استدلال می کنند که دیدگاه دیگر این است که اماس در ابتدا بهعنوان یک اختلال نورودژنراتیو در نظر گرفته میشود و مرگ نورون ها، میلین را آزاد می کند و باعث ایجاد یک واکنش خود ایمنی ثانویه می شود.
با در نظر گرفتن این موضوع، لیو و تیمش بر اساس تحقیقات قبلی ترکیب مولکولی کوچکی را مشخص کرده اند که در مبارزه با ام اس در دو حیوان مختلف، موثر است.
محققان افزودند: گروه ما قبلاً متوجه شد که تعاملات پروتئینی مربوط به زیر واحد GluA2 از گیرندههای AMPA در تنظیم مرگ سلولی اکسیتوتوکسیک نقش دارند و قطع این تعاملات باعث کاهش نقایص عصبی، دمیلیناسیون و آسیب اکسون در موشهای EAE شده است. واضح است که شواهد به گیرنده های یونوتروپیک گلوتامات به عنوان هدفی برای محافظت عصبی در ام اس اشاره می کنند.
در حالی که مهار گیرندههای گلوتامات AMPA و NMDA قادر به بازگرداندن نقصهای عصبی در جوندگان بود، آنها قبلاً با عوارض جانبی جدی نیز همراه بودهاند. این ترکیب جدید نشان داد که میتواند مکانهایی را برای تنظیم عملکرد AMPA هدف قرار دهد و بدون اینکه بر سیستم عصبی مرکزی تأثیر بگذارد، محافظت عصبی را ارائه دهد.
در مرحله بعد، تحقیقات پیش بالینی بیشتری شامل بررسی کامل ایمنی و پایداری این روش انجام خواهد شد. با این حال، الگوهایی بر روی این مطالعات ثبت شده است و تیم انتظار دارد که بتواند کار خود را در چند سال آینده به آزمایش انسانی برساند.
محققان گزارش کردند: کاندید اصلی دارای اثرات قوی در بازگرداندن عملکرد عصبی و میلینسازی و کاهش پاسخ ایمنی در آنسفالیت خودایمنی تجربی و موش های مبتلا به اماس بدون تاثیر بر انتقال عصبی پایه یا یادگیری و حافظه است.
در همین حال، با آزمایش چند دارو با هدف از بین بردن آسیب عصبی ناشی از این نوع بیماری، اولین آزمایش تطبیقی برای استرالیاییهای مبتلا به ام اس پیشرونده در ژانویه آغاز میشود. حدود 40 درصد از مبتلایان به ام اس با این فرم پیچیده و پیشرونده زندگی می کنند که با تخریب مداوم عصبی مشخص می شود.
دکتر جولیا موراهان، رئیس تحقیقات ام اس استرالیا گفت: ما امیدواریم که این تحقیق منجر به نتایج آزمایشی مثبتی شود که کاربردی عملی داشته باشد و امید جدیدی را برای بهبود مراقبت برای افراد مبتلا به ام اس پیشرونده در استرالیا و فراتر از آن فراهم کند.