به دنبال شواهدی که تقریباً 25 سال پیش با مطالعه بر روی مگسهای سرکه آغاز شد، محققان به این نتیجه رسیدند که افزودن یک نوع بیش فعال از پروتئین Rac2 به ماکروفاژها باعث میشود آنها سلول های T را به سلول های آدم خوار تبدیل کنند.
به گزارش تکناک، این تکنیک جدید به طور موثر می تواند اثربخشی یکی از درمانهای در حال ظهور سرطان را افزایش دهد.
پروتئین های Rac برای مدت طولانی در دسترس بوده اند. تصور میشود که این پروتئینها که در تکامل عمیقاً حفظ شدهاند، در اولین سلول های هستهدار وجود داشتهاند. اما علیرغم سن آنها، دانشمندان هنوز در حال کشف اسرار آنها هستند. در یک مطالعه جدید، محققان دانشگاه کالیفرنیا سانتا باربارا (UCSB) اطلاعات بیشتری در مورد نحوه عملکرد پروتئینهای Rac و چگونگی بهبود درمان سرطان توسط آنها کشف کردند.
ژنوم انسان سه پروتئین Rac را رمزگذاری می کند. Rac1 در همه جا فعال می شود، Rac2 عمدتاً در سلول هایی که اجزای خون را تولید می کنند (سلول های خونساز)، و Rac3 عمدتاً در بافت مغز فعال می شود. در سال 1996، محققانی که روی مگسهای سرکه مطالعه میکردند، کشف کردند که پروتئینها در حرکت سلولی نقش دارند و شکل بیشفعالی Rac1 که تنها در چند سلول در تخم مگس فعال میشود، کل بافت را از بین میبرد.
میشرا که نویسنده اصلی این مطالعه است، گفت: تنها فعالیت این Rac فعال در شش تا هشت سلول، کل بافت را که از حدود 900 سلول تشکیل شده است، می کشد.
در سال 2019، مطالعهای که در مجله Blood منتشر شد، بر روی سه فرد غیر مرتبط با عفونتهای مکرر و کمبود قابلتوجه سلول های T که گلبولهای سفید تخصصی هستند که وجود آنها برای سیستم ایمنی ضروری است، گزارش داد که دارای همان جهشی هستند که Rac2 را بیشفعال میکند. این مطالعه همچنین مشاهده کرد که بسیاری از نوتروفیلهای بیمار که سلول های هستند که میکروارگانیسمهای مهاجم را میگیرند و میخورند، بزرگ شدهاند که نشان میدهد آنها مواد سلولی زیادی مصرف میکنند.
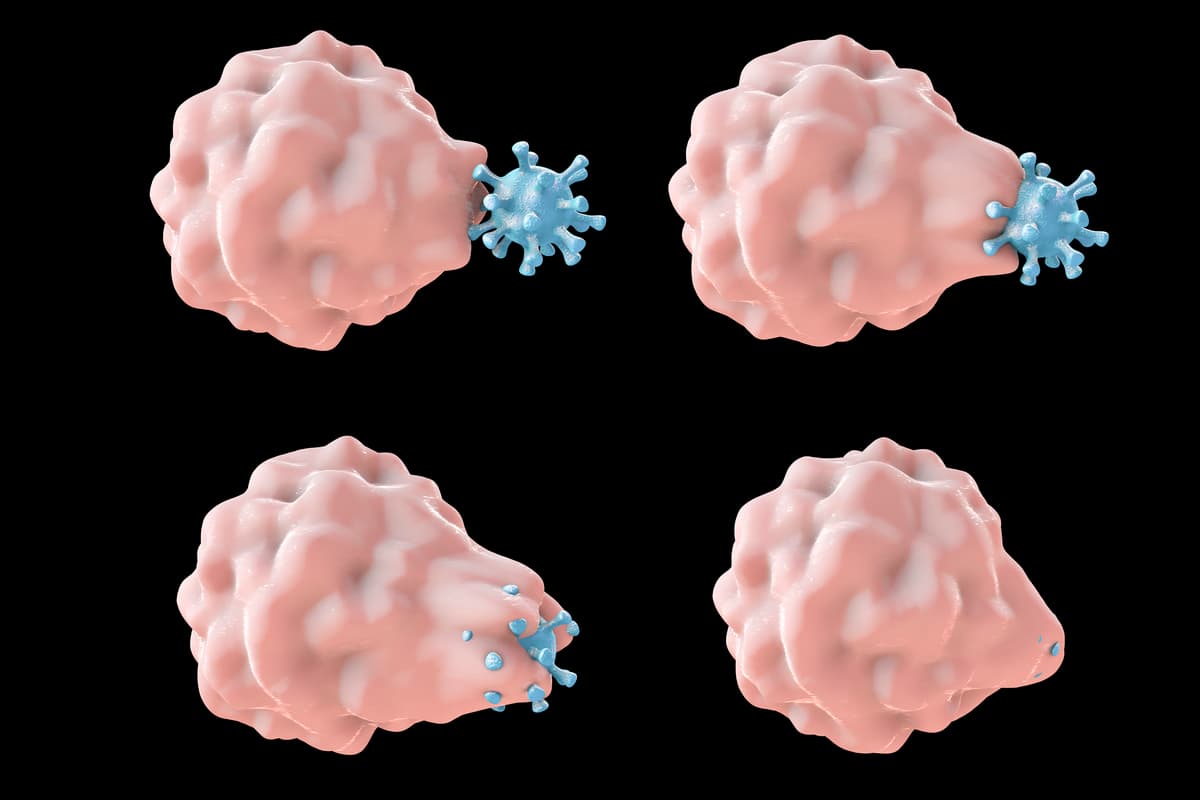
پس از خواندن این مطالعه، دنیس مونتل که نویسنده مسئول مطالعه حاضر است، از خود پرسید که آیا ناپدید شدن سلول های T به دلیل سلول های ایمنی ذاتی با خوردن Rac2 فعال آنها است؛ چیزی که در مگس سرکه اتفاق افتاد. بنابراین مونتل و سایر محققان تمرکز خود را بر روی ماکروفاژها که همتای حریص نوتروفیلها هستند، معطوف کردند. محققان ماکروفاژهای انسانی را با و بدون Rac2 بیش فعال همراه با سلول های T کشت دادند و به این نتیجه رسیدند که ماکروفاژهای دارای Rac بیش فعال، سلول های بیشتری مصرف می کنند و این فرضیه آنها را تایید می کند.
سپس محققان با استفاده از نمونههای مغز استخوان موشهایی با همان جهش Rac2 بیش فعال که در بیماران مورد مطالعه در سال 2019 مشاهده شد، سلول های بنیادی مغز استخوان را به ماکروفاژ تبدیل کردند. آزمایش مشابهی انجام شد، اما این بار هر دو ماکروفاژها و سلول های T را با و بدون جهش Rac2 مخلوط کردند. آنها به این نتیجه رسیدند که نه تنها ماکروفاژهای دارای Rac فعال به میزان قابل توجهی سلول های T بیشتری مصرف می کنند، بلکه سلول های T با Rac2 فعال نیز در برابر مصرف آسیب پذیرتر هستند، خواه جهش داشته باشند یا نداشته باشند.
سپس ماکروفاژها را از مغز استخوان موشهای عادی و جهش یافته با Rac2 فعال کردند. در هر گروه، ماکروفاژها بهمنظور فعالیت یک گیرنده ساختگی یا گیرنده آنتی ژن کایمریک (CAR) ساخته شدند که برای هدف قرار دادن سلول های B که نوع دیگری از سلول های ایمنی هستند، طراحی شده اند. محققان کشف کردند که ماکروفاژها با گیرنده های ساختگی، سلول های B زیادی را نمی خورند. با این حال، ماکروفاژها با Rac و CAR بیش فعال، دو برابر بیشتر از گروه دارای فقط CAR سلول B خوردند. همچنین به نظر می رسید که Rac2 فعال شده تعداد به اصطلاح “ابرخورندهها” را افزایش میدهد که ماکروفاژهای درندهای هستند که چندین سلول سرطانی را می خورند و می کشند.
مونتل گفت: اگر Rac فعال را بدون گیرنده مناسب اضافه کنید، هیچ کاری انجام نمی دهد.
CAR-T یک ایمونوتراپی فعلی سرطان است که از سلولهای T خود بیمار استفاده میکند و آنها را مهندسی میکند و CAR را برای کمک به اتصال سلولها به یک آنتیژن سلول سرطانی خاص که سلولها هدف قرار میدهند و به آن حمله میکنند، اضافه میکند. این درمان در برابر برخی سرطان ها مانند لوسمی و لنفوم بسیار موثر است، اما سرطان های تومور جامد نیز وجود دارند که به آن پاسخ نمی دهند.
CAR-M، یکی از انواع جدیدتر CAR-T است که به جای سلول های T به ماکروفاژها متکی است، اخیراً در تحقیقات مورد استفاده قرار گرفته است و تاکنون بی خطر تلقی شده است. با این حال، یک محدودیت CAR-M این است که ماکروفاژهای CAR تمایل دارند سلولها را بهجای بلعیدن، آنها را ذره ذره بخورند. بنابراین افزایش مصرف کل سلول هدف یک هدف مهم است.
محققان بهتازگی علاقه مند به مهار ماکروفاژهای CAR تقویت شده برای افزایش اثربخشی درمان های CAR-M هستند.
آنها همچنین قصد دارند به تحقیقات خود ادامه دهند تا بررسی کنند که آیا روش جدید آنها که در آزمایشگاه مؤثر بود، در سلولهای ایمنی انسانی تازه جمعآوریشده و نمونههای سرطان حیوانی اعمال میشود یا خیر. آنها در حال بررسی نحوه عملکرد Rac2 در سطح مولکولی برای اعمال اثرات خود هستند.
این مطالعه در مجله PNAS منتشر شد.