فهرست مطالب
تحقیق جدیدی از مؤسسۀ پیکاور در دانشگاه MIT نشان میدهد که کتامین چگونه بر عملکرد مغز و خلق و خو تأثیر میگذارد.
به گزارش تکناک، این مطالعه، که با استفاده از مدلسازی محاسباتی انجام شده است، تأثیرات کتامین بر گیرندههای NMDA در قشر مغز را توضیح و نشان میدهد که چگونه این دارو میتواند حالتهای هشیاری تغییر یافته و مزایای درمانی احتمالی را ایجاد کند. این یافتهها میتواند به توسعۀ کاربردهای بالینی مؤثرتر و درک بهتری از تأثیرات گستردۀ دارو بر دینامیکهای شبکهای مغز منجر شود.
کتامین که توسط سازمان بهداشت جهانی به عنوان یک داروی ضروری شناخته شده است، برای اهداف مختلفی از جمله آرامبخشی، مدیریت درد، بیهوشی عمومی و درمان افسردگی مقاوم به درمان استفاده میشود. اگرچه اثرات آن بر فعالیت مغز و هدف آن در سلولهای مغز شناخته شده است، امّا تاکنون ارتباط میان این جنبهها نامشخص بود. یک مطالعۀ جدید که توسط محققان در چهار مؤسسۀ منطقۀ بوستون انجام شده، از شبیهسازی محاسباتی برای کشف جزئیات فیزیولوژیکی که در گذشته نادیده گرفته شده بودند، استفاده کرده است. این تحقیق بینش جدیدی در مورد مکانیسمهای شیوۀ عملکرد کتامین ارائه میدهد.
امری براون، نویسندۀ ارشد این مطالعه گفت: این شبیهسازی به رمزگشایی مکانیسمهای احتمالی کمک کرده است، که با استفاده از آن کتامین حالتهای برانگیختگی تغییر یافته و فواید درمانی برای درمان افسردگی را ایجاد میکند.
محققان MIT، دانشگاه بوستون، بیمارستان عمومی ماساچوست و دانشگاه هاروارد اعلام کردند: پیشبینیهای شبیهسازی آنها که در 20 می در مجموعه مقالات آکادمی ملی علوم منتشر شد، میتواند به پزشکان در استفادۀ بهتر از این دارو کمک کند.
الی آدام، یکی دیگر از محققان ارشد این مطالعه بیان کرد: زمانی که پزشکان بفهمند هنگام تجویز یک دارو بهطور مکانیکی چه اتفاقی رخ میدهد، به احتمال زیاد میتوانند از آن مکانیسم استفاده کرده و آن را دستکاری کنند. با این بینش آنها متوجه خواهند شد که چگونه اثرات خوب دارو را تقویت کنند و چگونه اثرات بد را کاهش دهند.
01
از 03مسدود کردن ورودی
پیشرفت اصلی این مطالعه شامل شبیهسازی بیوفیزیکی بود و نشان داد، زمانی که کتامین گیرندههای “NMDA” در قشر مغز را که لایۀ بیرونی مغز است و در آن عملکردهای کلیدی مانند پردازش حسی و شناخت انجام میشود را مسدود میکند، باعث تعدیل انتشار گلوتامات انتقالدهندۀ عصبی تحریکی خواهد شد.
هنگامی که کانالهای عصبی (یا دریچههای) تنظیمشده توسط گیرندههای NMDA باز میشوند، معمولاً به آرامی بسته خواهند شد (مانند دری با یک دریچۀ هیدرولیکی که از برخورد آن جلوگیری میکند) و با این کار به یونها اجازه میدهند به داخل و خارج نورونها بروند و در نتیجه خواص الکتریکی آنها را تنظیم کنند. امّا کاناهای گیرنده میتواند توسط یک مولکول مسدود شود. مسدود کردن منیزیم به تنظیم طبیعی جریان یون کمک میکند. با با وجود این، کتامین یک مسدودکنندۀ بسیار مؤثر است.
انسداد باعث کُند شدن ولتاژ در غشای نورون میشود، که در نهایت یک نورون را به سمت اسپایک یا ارسال یک پیام الکتروشیمیایی به نورونهای دیگر سوق میدهد. درگاه NMDA با بالا رفتن ولتاژ باز میشود. این وابستگی متقابل میان ولتاژ، اسپایکینگ و مسدود کردن، میتواند گیرندههای NMDA را با فعالیت سریعتری نسبت به سرعت بسته شدن آهستۀ آن تجهیز کند. مدل محققان با نشان دادن اینکه چگونه انسداد و رفع انسداد کتامین بر فعالیت عصبی تأثیر میگذارد، فراتر از مدلهای قبلی است.
نانسی کوپل، یکی از محققان این مطالعه تأکید کرد: جزئیات فیزیولوژیکی که در بیشتر مواقع نادیده گرفته میشوند، گاهی اوقات میتوانند در درک پدیدههای شناختی نقش اساسی داشته باشند. پویایی گیرندههای NMDA تأثیر بیشتری بر پویایی شبکه نسبت به آنچه قبلاً تصور میشد، دارند.
دانشمندان با مدل خود شبیهسازی کردند که چگونه دوزهای مختلف کتامین که بر گیرندههای NMDA تأثیر میگذارد، و فعالیت یک شبکه مغز نمونه را تغییر میدهد. شبکۀ شبیهسازی شده شامل انواع نورونهای کلیدی موجود در قشر مغز است، که یک نوع تحریکی و دو نوع بازدارنده هستند و بین نورونهای تونیک که فعالیت شبکه را کاهش میدهند و نوروهای فازی که بیشتر به نورونهای تحریککننده واکنش نشان میدهند، تمایز قائل میشود.
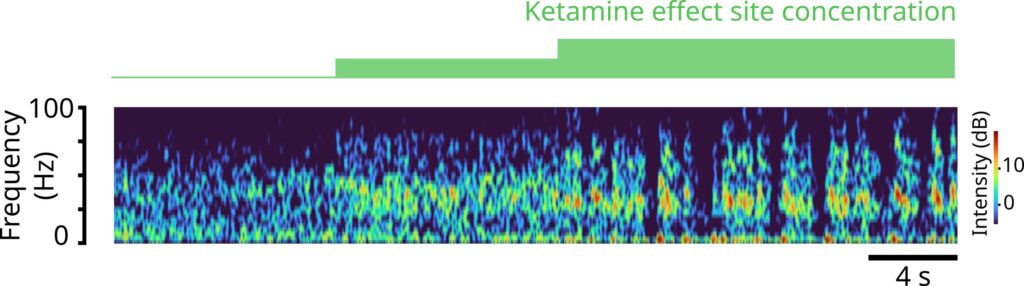
شبیهسازیهای محققان با موفقیت توانست امواج مغزی واقعی را که از طریق الکترودهای EEG روی پوست سر یک داوطلب انسانی که دوزهای مختلف کتامین دریافت کرده بود و اسپایک عصبی در حیواناتی که دارای آرایههای الکترودی کاشته و اندازهگیری شده بود، بازبینی کنند. در دوزهای پایین، کتامین قدرت امواج مغزی را در محدودۀ فرکانس گامای سریع (30-40 هرتز) افزایش داد. در دوزهای بالاتری که باعث بیهوشی میشود، آن امواج گاما بهطور دورهای توسط حالتهای پایین که در آن امواج دلتا با فرکانس بسیار آهسته رخ میدهند، قطع میشوند. این اختلال مکرر امواج با فرکانس بالاتر عملکردی است که میتواند ارتباط را در سراسر قشر مختل کرده تا درنهایت هوشیاری را از بین ببرد.
02
از 03یافتههای کلیدی
با استفاده از شبیهسازی، محققان چندین مکانیسم کلیدی را در شبکه توضیح دادند که دقیقاً این پویاییها را ایجاد میکنند.
اولین پیشبینی این است که کتامین میتواند با خاموش کردن برخی از نورونهای بازدارنده، فعالیت شبکه را مهار کند. شبیهسازی نشان میدهد که سینتیک طبیعی مسدود کردن و رفع انسداد گیرندههای NMDA میتواند جریان کوچکی را در زمانی که نورونها اسپایک نمیشوند، وارد کند. بسیاری از نورونهای شبکه که در سطح مناسبی از برانگیختگی قرار دارند، برای افزایش خود به خود به این جریان تکیه میکنند. امّا وقتی کتامین سینتیک گیرندههای NMDA را مختل میکند، آن جریان را خاموش و این نورونها را سرکوب میکند. در این مدل، با وجود اینکه کتامین بهطور یکسان به همۀ نورونها آسیب میزند، این نورونهای بازدارندۀ تونیک هستند که خاموش میشوند، چرا که بهطور اتفاقی در آن سطح از تحریک قرار دارند. این باعث آزاد شدن سایر نورونها، تحریککننده یا بازدارنده از مهارشان میشود و به آنها اجازه میدهد به شدت بالا بروند و باعث حالت مغزی برانگیخته کتامین شوند. سپس افزایش تحریک شبکه میتواند باز کردن سریع (و مسدود کردن مجدد) گیرندههای NMDA نورونها را فعال کند و انفجار ناگهانی رخ خواهد داد.
پیشبینی دیگر این است که این انفجارها با امواج فرکانس گاما که با کتامین دیده میشوند، هماهنگ خواهند شد، چگونه؟ محققان کشف کردند که نورونهای بازدارندۀ فازیک، توسط ورودیهای زیادی از انتقالدهندۀ عصبی گلوتامات از نورونهای تحریککننده، تحریک میشوند و بهشدت میجهند. هنگامی که آنها این کار را انجام میدهند، یک سیگنال بازدارنده از انتقالدهندۀ عصبی GABA به نورونهای تحریککننده ارسال میشود، که شلیک تحریک را مهار میکنند؛ تقریباً مانند یک معلم مهدکودک که در کل کلاس، بچههای هیجانزده را آرام میکند. سیگنال توقف، که بهطور همزمان به همۀ نورونهای تحریککننده میرسد، تنها به مدت طولانی دوام میآورد، در نهایت فعالیت آنها را همگام میکند و یک موج مغزی گامای هماهنگ تولید میشود.
میشل مک کارتی، یکی از محققان این مطالعه اعلام کرد: یافتهها مبنی بر اینکه یک گیرندۀ سیناپسی منفرد (NMDA) میتواند نوسانات گاما ایجاد کند و این نوسانات گاما میتوانند بر گامای سطح شبکه تأثیر بگذارند، غیرمنتظره بود. این یافته تنها با استفاده از یک مدل فیزیولوژیکی دقیق از گیرندۀ NMDA پیدا شد. این سطح از جزئیات فیزیولوژیکی، یک مقیاس زمانی گاما را نشان داد که در اکثر موارد با گیرنده NMDA مرتبط نیست.
حالات افت دورهای که با دوزهای بالاتر کتامین القاکنندۀ ناهشیاری ظاهر میشوند، چگونه رخ میدهند؟ در شبیهسازی، فعالیت فرکانس گاما نورونهای تحریکی، نمیتواند برای مدت طولانی توسط سینتیک گیرنده NMDA مختلشده حفظ شود. نورونهای تحریککننده در اصل تحت مهار GABA از درون نورونهای فازیک خسته میشوند که حالت پایین را تولید میکنند. امّا پس از توقف ارسال گلوتامات به سلولهای عصبی فازیک، این سلولها تولید سیگنالهای GABA بازدارندۀ خود را متوقف خواهند کرد، که نورونهای تحریک کننده را قادر میسازد تا بازیابی شوند و چرخهای را از نو شروع کنند.
03
از 03ارتباط ضد افسردگی؟
این مدل پیشبینی دیگری انجام میدهد که ممکن است به توضیح چگونگی اعمال اثرات ضد افسردگی کتامین کمک کند. افزایش فعالیت گامای کتامین میتواند فعالیت گاما را در میان نورونهایی که پپتیدی به نام VIP را فعال میکنند، جذب کند. مشخص شده که این پپتید دارای اثرات ارتقاءدهندۀ سلامتی مانند کاهش التهاب است، که بسیار طولانیتر از اثرات کتامین بر گیرندههای NMDA میباشد. محققان میگویند که حباب این سلولهای عصبی تحت کتامین میتواند آزادسازی پپتید مفید را افزایش دهد، به همان صورتی که وقتی این سلولها در آزمایشها تحریک شده بودند، مشاهده شد. همچنین این پیشبینی به ویژگیهای درمانی کتامین اشاره میکند که امکان دارد فراتر از اثرات ضد افسردگی باشد. با وجود این، محققان اذعان میکنند که این ارتباط فقط یک حدس و گمان است و باید منتظر تأیید آزمایشی خاص باشیم.
کوپل گفت: درک اینکه جزئیات سلولی گیرنده NMDA میتواند باعث افزایش نوسانات گاما شود، مبنای یک نظریۀ جدید در مورد این است که چگونه کتامین امکان دارد برای درمان افسردگی مؤثر باشد.