از زمان موفقیت واکسن کووید-19، درمان های RNA ،موضوع مورد توجه روزافزون دنیای بیوتکنولوژی بوده است. این درمانها با بدن شما کار میکنند تا ریشه ژنتیکی بیماریها و عفونتها را هدف قرار دهند.
به گزارش تکناک، استفاده از این روش،یک روش درمانی جایگزین امیدوارکننده برای داروهای سنتی است.
بزرگترین چالش در توسعه یک درمان موفق RNA، تحویل هدفمند آن است. تحقیقات در حال حاضر با محدودیتهای فعلی LNPs مواجه است که بسیاری از بیماریها را بدون درمان موثر RNA رها کرده است.
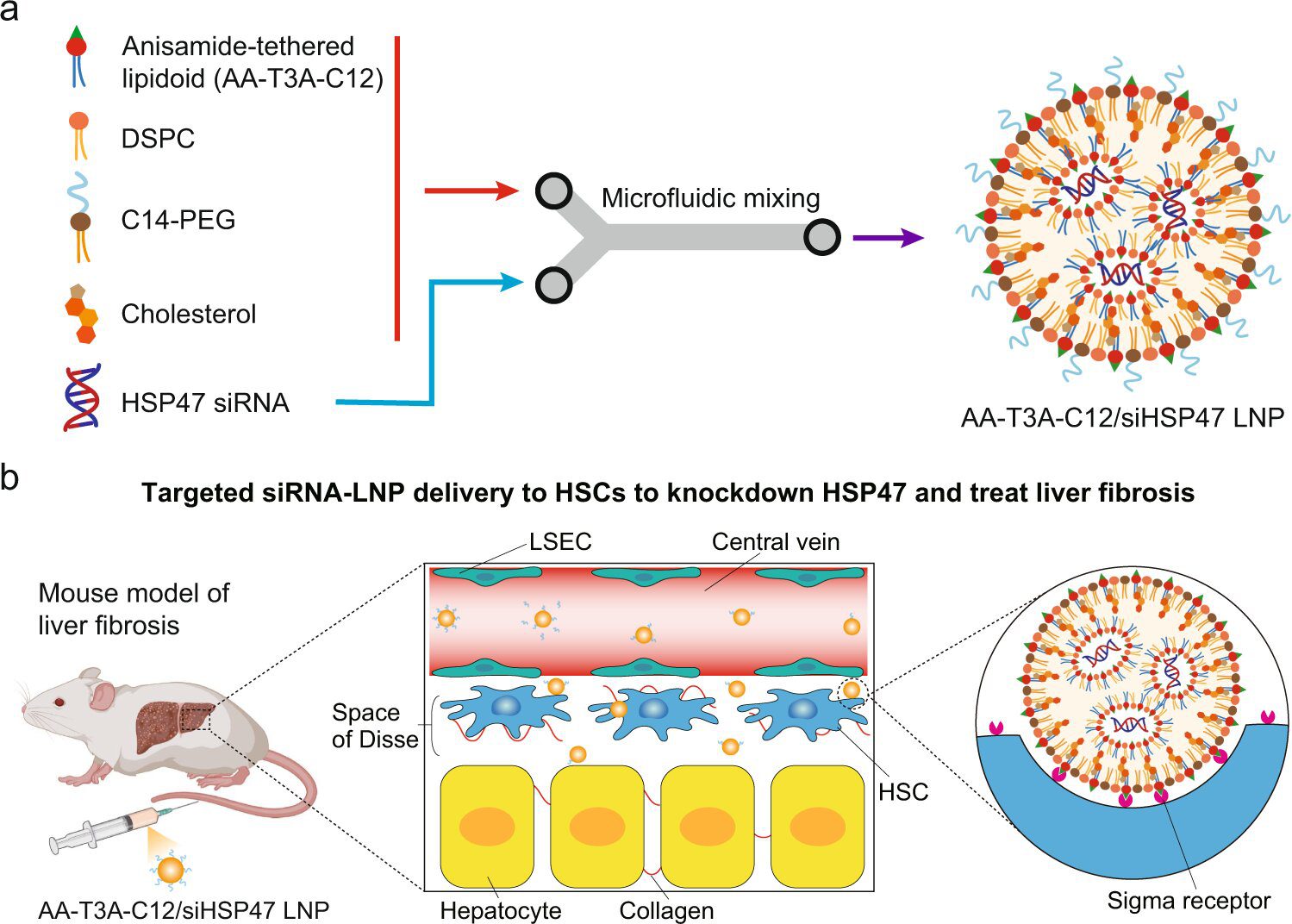
فیبروز کبد زمانی رخ می دهد که کبد به طور مکرر آسیب ببیند و روند بهبودی منجر به تجمع بافت اسکار شود و عملکرد سالم کبد را مختل کند. این بیماری یک بیماری مزمن است که با تجمع بیش از حد ماتریکس خارج سلولی غنی از کلاژن (ECM) مشخص می شود. درمان فیبروز کبدی با استفاده از درمانهای RNA به دلیل فقدان سیستمهای تحویل برای هدف قرار دادن فیبروبلاستهای فعال ساکن کبد، همچنان چالش برانگیز است. هم ساختار فیبروبلاست جامد و هم فقدان ویژگی یا میل ترکیبی برای هدف قرار دادن این فیبروبلاستها، مانع از ورود LNPهای فعلی به فیبروبلاستهای فعال ساکن کبد شده بنابراین آنها قادر به ارائه درمانهای RNA نیستند.
مایکل میچل، جی پیتر و گری اسکیرکانیچ، و همکاران شان در این تحقیق، زوکسیانگ هان و نینگ کیانگ گونگ، متوجه شدند که برای مقابله با این موضوع و کمک به ارائه درمان برای میلیون ها نفری که از این بیماری مزمن رنج می برند،بایدروشی جدید برای سنتز LNP های متصل به لیگاند، افزایش گزینش پذیری آنها و امکان هدف قرار دادن فیبروبلاست های کبدی پیدا کنند.
مطالعه آنها که در مجله Nature Communications منتشر شده است، نشان می دهد که چگونه یک لیگاند(ماده شیمیایی) مولکولی کوچک میل به فیبروبلاست های فعال شده در کبد را ایجاد می کند و به سختی ساخت کلاژن را هدف قرار می دهد.
تجمع کلاژن با افزایش آزادسازی پروتئین شوک حرارتی 47 (HSP47) همراه است که پروتئینی است که بیوژنس(زیست زایی)و ترشح کلاژن را هدایت می کند. آزادسازی بیش از حد پروتئین HSP47 و افزایش بیوژنز کلاژن، در نهایت به فیبروز تبدیل می شود.
هنگامی که LNP های آنها به سلول هدف رسیدند و وارد آن شدند، siRNA آزاد می شود تا HSP47 را خاموش کند، تولید کلاژن را مهار کند و فیبروز را در مسیرهای آن متوقف سازد.این درمان که در موش ها موفقیت آمیز نشان داده شده است، یک درمان RNA امیدوارکننده برای فیبروز کبدی در انسان است.
این رویکرد جدید برای سنتز لیپیدهای قابل یونیزاسیون، کلید باز کردن درهای بیشتری برای کاربردهای درمانی RNA برای درمان بیماریهای مختلف است.
دکتر میچل گفت: برای اینکه LNP هایی به اندازه کافی مناسب را برای هدف قرار دادن سلول های ستاره ای کبدی یعنی آنهایی که فیبروز را تحریک می کنند، انتخاب کنیم، یک لیگاند آنیسامید که مولکولی است که میل ترکیبی بالایی با گیرنده روی این سلول های ستاره ای دارد، در ساختار لیپید یونیزاسیون پذیر وارد کردیم. اساسا، ما یک مکانیسم قفل و کلید را برای هدف قرار دادن و باز کردن تحویل به این سلولهای غیرقابل دسترسی ایجاد کردیم.
فرآیند سنتز توسط هان و همکارانش به عنوان یک فرآیند “یک در دو مرحله ای” توسعه داده شد. برای ایجاد مجموعه ای از لیپیدهای قابل یونیزاسیون، تیم تحقیقاتی ابتدا یک پیش ساز لیگاند آنیسامید (AA) و هسته های آمینه مختلف را کنار هم قرار دادند. آنها سپس دمی آبگریز را برای ایجاد لیپیدهای یونیزاسیون AA اضافه کردند. انیسامید به دلیل ماهیت خنثی و پایدار و همچنین تمایل آن به گیرندههای سیگما بیش از حد در سلولهای ستارهای، به عنوان لیگاند انتخاب شد. هنگامی که مجموعه LNP های متصل به AA ایجاد شد، تیم تحقیقاتی توانایی آنها را برای هدف قرار دادن و ارائه درمان به سلول ها از طریق یک فرآیند انتخاب، دو دور تجزیه و تحلیل کرد.
هان گفت: ما نیاز داشتیم یک LNP خاص متصل به AA پیدا کنیم که هم قوی و هم مناسب باشد. دور اول فرآیند انتخاب با بررسی اینکه LNP های ما چقدر می توانند پروتئین فلورسانس سبز (GFP) را در فیبروبلاست ها برای اندازه گیری قدرت از بین ببرند، انجام شد. GFP شواهد بصری بسیار خوبی را برای اینکه چگونه RNA درمانی،آزادسازی ژن را در زمان واقعی خاموش می کند ارائه می دهد.
وی ادامه داد: در دور دوم، ما توانایی انتخابی این LNP قدرتمند را آزمایش کردیم. ما این کار را با مسدود کردن گیرنده سیگما انجام دادیم تا بفهمیم که گروه لیگاند AA خاص چقدر در توانایی LNP ها برای ورود به سلول های هدف مهم است. در حقیقت ما نشان دادیم که گروه AA قابل توجه است؛ پس از محاصره گیرنده سیگما، قفل و کلید را از دست دادیم و دیدیم که LNP متصل به AA وارد سلول هدف نمی شوند.
این تیم AA-T3A-C12 را به عنوان یک siRNA درمانی قوی و انتخابی حامل LNP شناسایی کردند که قادر به کاهش 65 درصدی آزادسازی HSP47 در موش ها و همچنین بهبود بافت آسیب دیده کبد است. نتایج این مطالعه نشان می دهد که AA-T3A-C12 LNP از MC3 LNP که یک ناقل غیر ویروسی است که برای درمان های بالینی استفاده میشود و برای استفاده در درمان RNA سلولی فیبروز کبدی مورد تایید FDA قرار گرفته است، بهتر عمل میکند.
این LNP جدید متصل به لیگاند، نوعی درمان RNA برای فیبروز کبدی ارائه میکند و به وسیله ی سنتز راهی برای تطبیق LNPها با سایر سلولها و بافتهای بدن که قبلاً هدفشان سخت بود، فراهم میکند.
هان می گوید: پتانسیل LNP ها بسیار زیاد است، ما LNP ها را هوشمندتر و کارآمدتر می کنیم.
میچل افزود: ما هیجان زده ایم که یک درمان عالی پیدا کرده ایم که ریشه ژنتیکی این بیماری کبدی را برطرف می کند. و از آنجایی که این وسیله انتقال LNP ،در سلول های فیبروتیک کبد کار می کند، ممکن است منجر به ایجاد درمانی برای انواع دیگر فیبروز در بدن شود، مانند فیبروزی که در ریه یا تومورها ایجاد می شود.
وی در ادامه گفت: فراتر از آنچه در کبد بررسی کرده ایم، این روش ایجاد LNP می تواند برای درمان انواع سلول های دیگر استفاده شود. ما به طور بالقوه میتوانیم سلولهای مغز، ریهها یا قلب را با نصب لیگاندهای هدفگیری خاص در ساختار لیپیدی قابل یونیزاسیون هدف قرار دهیم. راه های زیادی در اینجا وجود دارد و ما هیجان زده هستیم که این تحقیقات را در جهت های جدیدی ادامه دهیم.