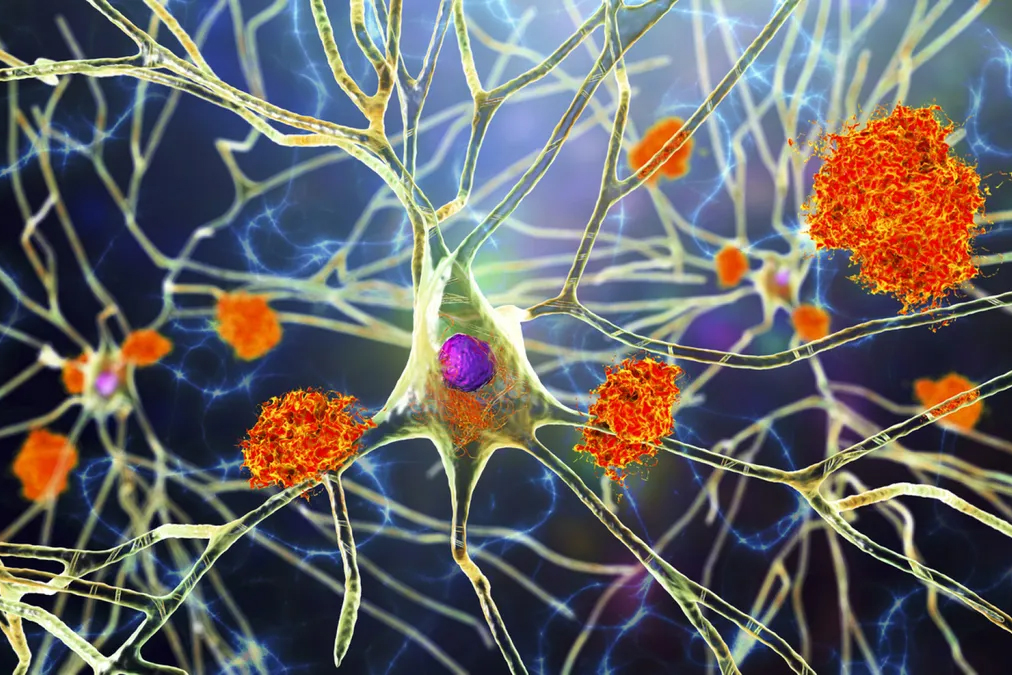
محققان نحوه تجمع پروتئین های سمی در مغز را در مراحل اولیه بیماری آلزایمر با استفاده از روشی منحصر به فرد از ریاضیات نشان دادند.
به گزارش تک ناک، آنها از یک مدل ریاضی جدید برای نشان دادن نحوه تجمع پروتئین ها در مغز استفاده کرده اند.
تیم تحقیقاتی از دانشکده فیزیک، مهندسی و فناوری دانشگاه یورک، اظهار داشت که این کشف میتواند در درمانهای آینده نقش داشته باشد.
بیماری
بیماری آلزایمر شایع ترین نوع زوال عقل است که 50 میلیون نفر در سراسر جهان به آن مبتلا هستند. پیش بینی می شود تعداد افراد مبتلا به این بیماری در کمتر از 30 سال سه برابر شود. اثرات بیماری آلزایمر می تواند بر مغز می تواند مخرب باشد.
بر اساس گزارش مرکز کنترل و پیشگیری از بیماری (CDC) تنها در ایالات متحده، نزدیک به 6 میلیون آمریکایی مبتلا به آلزایمر وجود دارد.افزایش سن بزرگترین عامل در ابتلا به آلزایمر است، اما سابقه خانوادگی نیز بر ابتلا به این بیماری تأثیر دارد. این بیماری میتواند باعث مرگ شود. این بیماری و یا نوعا هر بیماری که باعث زوال عقل می شود علت مرگ یک نفر از سه نفر سالمند در ایالات متحده است.
مطالعه
محققان گروه عمده ای از پروتئین های سمی را یافتند که در آلزایمر نقش دارند، به نام آمیلوئیدها. این پروتئین ها به شکل قطرات آب متراکم می شوند. سپس آنها خوشه هایی را تشکیل می دهند که بر عملکرد طبیعی مغز تأثیر می گذارد.
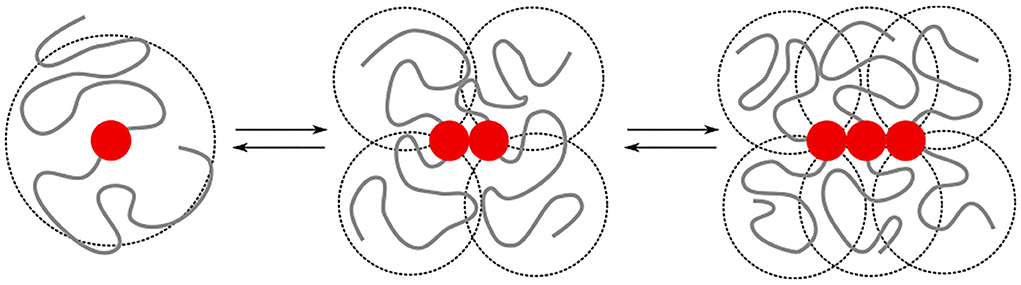
پروتئینهای آمیلوئید آلوده تقریباً 10 تا 15 سال قبل از نشان دادن اولین علائم با هم گروهبندی میشوند، اما قبلاً روش مطمعنی برای درک هملکرد این پروتئین ها وجود نداشت
تیم تحقیقاتی دو نوع پروتئین آمیلوئید را مشاهده کردند که هر دو به طور گسترده در آلزایمر یافت می شوند. آنها متوجه شدند که پروتئین ها در ابتدا قبل از تشکیل خوشه هایی که حاوی اشکال طولانی تر و سمی تر پروتئین هستند، قطرات پروتئینی به شکل قطرات آب را تشکیل می دهند.
خوشه های آمیلوئید و آلزایمر
اگرچه اعتقاد بر این است که پروتئینهای آمیلوئید بخش مهمی از سیستم ایمنی هستند، اما این نوع پروتئین با کنار هم گرفتن به اشکال غیرعادی است که قوی میشود. تشکیل پروتئین سمی در فعالیت های طبیعی مغز اختلال ایجاد می کند.
دکتر استیو کوین، پژوهشگر آلزایمر در بریتانیا و مدرس بیوفیزیک در دانشگاه یورک بریتانیا، گفت: درک روشهای دقیق در سطح مولکولی که از طریق آن خوشههای آمیلوئید تشکیل میشوند، ممکن است به ما کمک کند تا داروهای ضدخوشه بهتری برای مبارزه با بیماری آلزایمر در اولین مرحله ممکن طراحی کنیم.
او اشاره کرد که چگونه مطالعه رشد تارهای ایجاد شده توسط عنکبوت ها به درک تحقیقات خوشه های پروتئین کمک کرد. ما متوجه شدیم که همان روشهایی که قبلاً برای درک رشد تارهای عنکبوت تولید شده استفاده شده بود، میتواند برای درک ما از خوشهبندی آمیلوئید نیز به کار رود. کار ما اکنون پشتیبانی نظری از به اصطلاح فرضیه آمیلوئید را فراهم می کند و به توضیح شرایطی که در آن خوشه ها تشکیل می شوند، کمک می کند.
فرضیه آمیلوئید توضیح می دهد که آلزایمر می تواند ناشی از رسوب و تجمع ترکیبات آمیلوئید در بافت مغز باشد که باعث توسعه پاتوژن های بیماری آلزایمر می شود.
تیم تحقیقاتی اشاره کرد که این اولین بار است که جزئیات مراحل اولیه شروع خوشه های آمیلوئید بررسی شده است. دکتر چارلی شفر، نویسنده اصلی این مطالعه و پژوهش، دانشیار پژوهشی در دانشگاه یورک گفت: خواص خوشه های بزرگ از پیش شکل گرفته با جزئیات گسترده مورد مطالعه قرار گرفته است، اما تاکنون، ارزیابی مونتاژ اولیه جزئیات خوشه ها در سطح مولکولی دشوار بوده است.
محققان امیدوارند که کشف دقیق چگونگی تشکیل خوشه های پروتئین سمی، آنها را برای توسعه درمان های دارویی هدفمند برای بیماری آلزایمر در آینده آماده کند.