دانشمندان دانشگاه ییل مکانیسم نادیده گرفته ای که ممکن است عامل ابتلا به بیماری آلزایمر باشد را کشف کرده اند.
به گزارش تکناک، این تیم پروتئینی که میتواند نشانگر زیستی تشخیص زودهنگام بیماری و هدف درمانهای آینده را شناسایی کردند.
برای دههها، فرضیه اصلی علت بیماری آلزایمر حول پلاکهای آمیلوئید( تودههای درهم پیچیده پروتئینی به نام بتا آمیلوئید) میچرخید. از زمانی که آلویس آلزایمر، بیش از یک قرن پیش، برای اولین بار این بیماری را مطالعه و نامگذاری کرد، تجمع این پلاکها در مغز بیماران مبتلا به زوال عقل به طور مداوم مشاهده شده است.
پس از آن، دانشمندان بیشتر تحقیقات خود را بر کاهش و پاکسازی این پلاک ها متمرکز کرده اند، اما به طرز ناامیدکننده ای برخی داروها به طور مداوم در آزمایشات بالینی شکست خوردند. در حالی که پلاکها بهطور واضح با بیماری مرتبط هستند، به نظر میرسد که یا خود یک علامت هستند یا خیلی دیر به منظور برطرف شدن آسیب، از بین میروند.
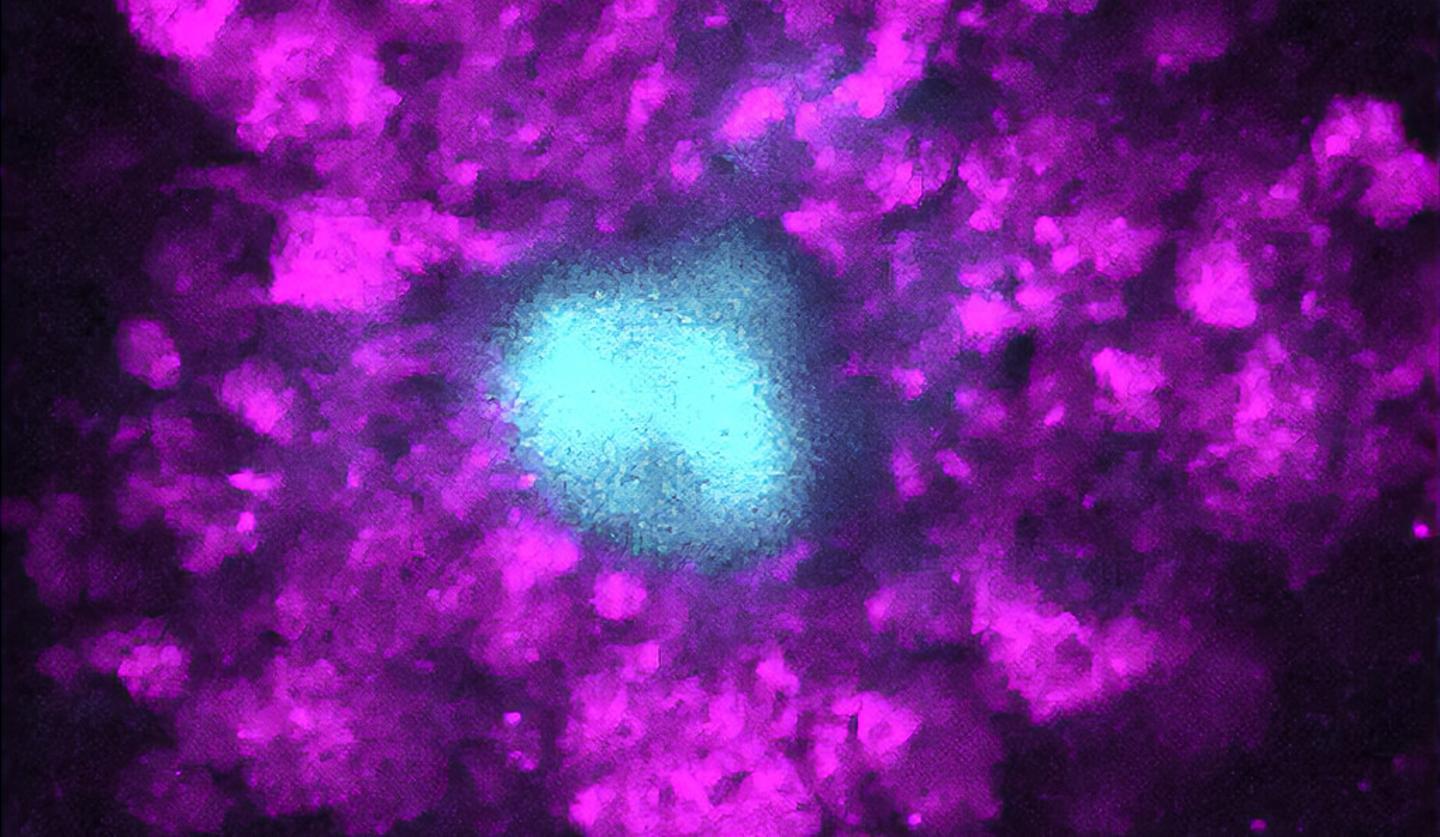
در این مطالعه جدید، محققان دانشگاه ییل به ویژگی متفاوت تورم کوچک و کروی شکل ظاهر شده توسط آلزایمر، توجه کردند. این پلاکها به عنوان ارسالکننده سیگنال به دیگر نورونها شناخته میشوند. تیم تحقیقاتی میگوید، بهطور عجیبی، با توجه به نقش بالقوه این تورمها در آسیبشناسی بیماری ، پیشتر بهطور دقیقی مورد مطالعه قرار نگرفته اند.
محققان دریافتند این تورم موجب کاهش انتقال سیگنال های الکتریکی در امتداد آکسون ها میشوند. هر چه تورم بیشتر، اختلال در سیگنال ها نیز بیشتر می شود و ممکن است موجب تحلیل عصبی بیشتر و ابتلا به زوال عقل گردد.
دکتر جیمی گروتزندلر، نویسنده ارشد این مطالعه گفت: ما یک علامت بالقوه آلزایمر با پیامدهای عملکردی بر مدارهای مغزی و با پتانسیل اختلال در فعالیت صدها آکسون عصبی و هزاران نورون متصل به هم را شناسایی کردهایم.
این تیم همچنین ریشه اصلی اسفروئیدها را شناسایی کردند. لیزوزوم ها ساختارهای کوچکی هستند که عمل دفع مواد زائد را در سلول ها انجام می دهند، اما در بیماران مبتلا به زوال عقل، سطوح بالاتر پروتئینی به نام PLD3 باعث چسبندگی لیزوزوم ها به هم در آکسون ها میشوند. که در نهایت موجب تورم می گردد.
در آزمایشات، محققان از ژن درمانی برای پاکسازی PLD3 در سلول های عصبی مدل های موش آلزایمری استفاده کردند. با این روش تورم آکسون به طور چشمگیری کاهش و به نوبه خود هدایت الکتریکی آنها و همچنین عملکرد نورون ها در آن ناحیه مغز بهبود یافت.
محققان میگویند این میتواند PLD3 را به نشانگر زیستی بیماری آلزایمر تبدیل کند و امکان تشخیص زودتر آن و هدف جدیدی برای درمانهای بالقوه فراهم کند.
گروتزندلر میگوید: ممکن است بتوان این شکست سیگنالهای الکتریکی در آکسونها را با هدف قرار دادن PLD3 یا سایر مولکولهای تنظیمکننده لیزوزومها، مستقل از وجود پلاکها، از بین برد.
البته نکاتی هم وجود دارد. این تحقیق تاکنون فقط بر روی موش ها انجام شده است، بنابراین هنوز مسیر طولانی برای بهکارگیری در انسانها باید طی کند. بعلاوه، به نظر می رسد مطالعات متناقضی در مورد نقش PLD3 در آلزایمر وجود دارد که نشان دهنده پیچیدگی کاملا آن است و ممکن است به سادگی مسدود کردن پروتئین نباشد.