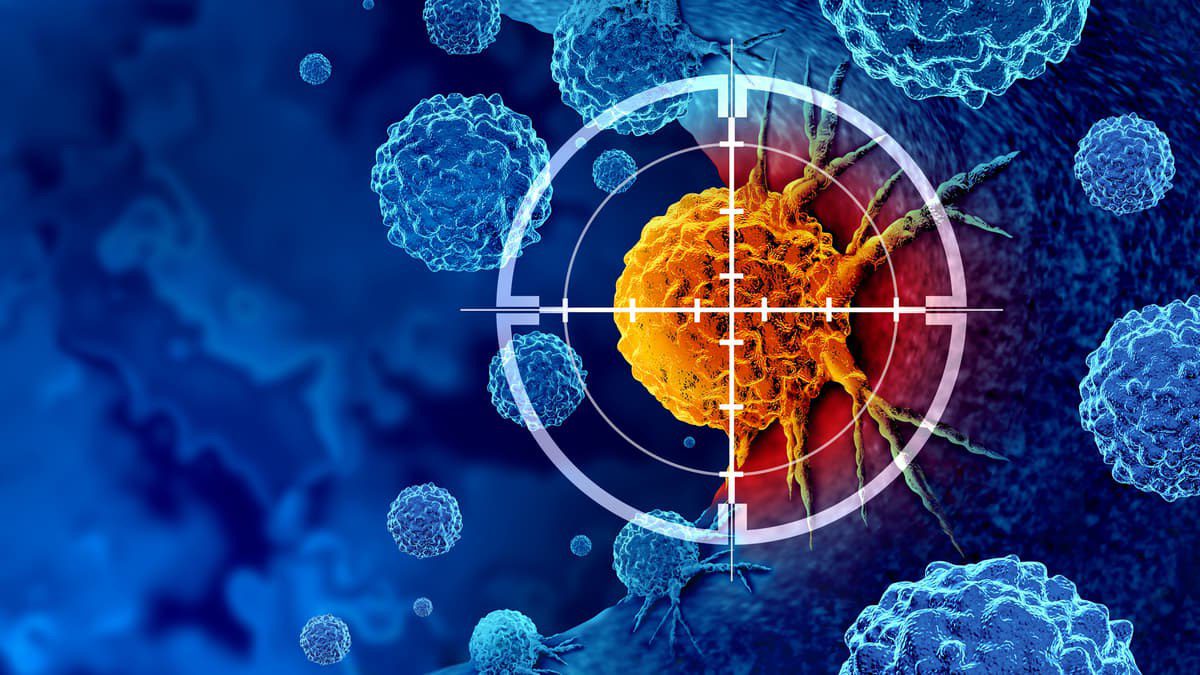
نانوپهبادهای جدید محققان بهطور انتخابی تومور را هدف قرار میدهند و گلبول های سفید بدن را قادر میسازند تا رشد سرطان را سرکوب کنند.
به گزارش تکناک، این کشف راه را برای توسعه درمان موثر برای از بین بردن تومور برای سرطانهایی که به سختی قابل درمان هستند، باز میکند.
گلبولهای سفید خون سلولهای کشنده طبیعی (NK) هستند که سلولهای آلوده و بیمار از جمله سلولهای سرطانی را با محدود کردن یا جلوگیری از انتشار آنها از بین میبرند.
همانطور که از نام آنها پیداست، آنها بهوجود آمدهاند تا بکشند، پس قادر به از بین بردن تهدیدات بالقوه بدون قرار گرفتن در معرض یک پاتوژن خاص هستند. اکنون محققان مؤسسه ملی علم و فناوری اولسان (UNIST) در کره جنوبی، از قدرت سلولهای NK استفاده کردهاند و نانو پهبادهایی را طراحی و ایجاد کردهاند که سلولها را درگیر کرده و آنها را به سمت هدف قرار دادن و از بین بردن سلولهای سرطانی هدایت میکند.
سلولهای NK میتوانند مستقیماً سلولهای سرطانی را با آزاد کردن گرانولهای سیتوتوکسیک (کشنده سلول) و سیتوکینهایی که سلولهای ایمنی دیگر را به محل تومور جذب میکنند، از بین ببرند و پاسخ ایمنی در برابر سلولهای سرطانی را تقویت کنند. به دلیل این تواناییها، یک دهه است که ایمونوتراپیهای مبتنی بر سلولهای NK مورد مطالعه قرار گرفتهاند، از جمله استفاده از درگیرکنندههای سلول NK .
درگیرکنندههای سلولهای NK پروتئینهای مهندسیشدهای هستند که برای اتصال انتخابی به سلولهای NK و سلولهای سرطانی هدف، قرار دادن آنها در نزدیکی و ترویج تخریب سلولهای سرطانی با واسطه NK طراحی شدهاند. در مطالعه حاضر، محققان یک قفس پروتئینی در مقیاس نانو ایجاد کردند که از باکتری Aquifex aeolicus (AaLS) به عنوان بستری برای تحویل هدفمند نانو پهبادهای درگیرکننده سلولهای NK (NKeNDs) که سلولهای NK را درگیر و فعال میکنند و متعاقباً آنها را به سلول های سرطانی خاص برای از بین بردن قفس AaLS با سیستم بستن پروتئین SpyTag (ST) تحویل میدهند، استفاده کردند تا این نانوپلتفرم را قادر سازد تا لیگاندهای متعدد را روی یک نانو پهباد نمایش دهد.
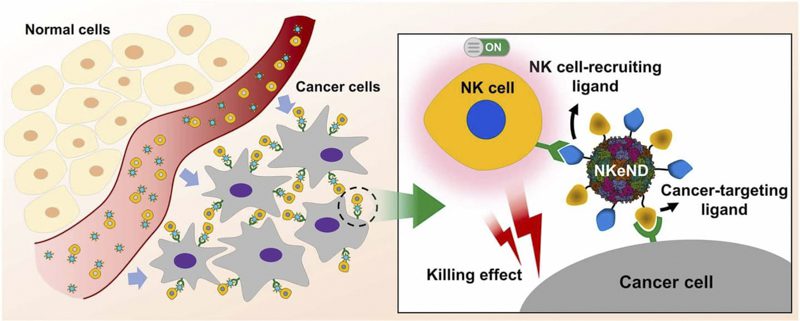
برای اطمینان از تحویل سلولهای NK به سلولهای سرطانی، محققان یک نانوبادی هدفگیری CD16 و پیوندهای پیوندی HER2 یا EGFR را در لیگاندهای اختصاصی سلولهای NK و سلولهای سرطانی به ترتیب به سطح نانوپلتفرم AaLS-ST خود متصل کردند. گیرنده CD16 روی سلولهای NK باعث میشود که آنها از طریق سمیت سلولی وابسته به آنتیبادی، اثربخش باشند. Affibodies (Afb) مقلدهای آنتی بادی، لیگاندهای پروتئینی مهندسی شده برای اتصال به پروتئین های هدف هستند. در این مورد، HER2 (فاکتور رشد اپیدرمی انسانی 2، پروتئینی که باعث رشد سلولهای سرطانی میشود) و EGFR (گیرنده فاکتور رشد اپیدرمی) پروتئینی روی سلولها است که به رشد آنها کمک میکند اما زمانی که ژن تولیدکننده آن جهش پیدا کند، سلولها می توانند بیش از حد رشد کنند و باعث سرطان شود.
محققان NKeND های خود را روی سلول های SK-OV-3 که یک رده سلولی سرطان تخمدان با فعالیت بیش از حد HER2 و سلول های MDA-MB-468 میباشد که یک رده سلولی سرطان سینه با فعالیت بیش از حد EGFR است، آزمایش کردند. دیده شد که NKeND ها که با رنگ فلورسنت برچسب گذاری شده بودند، به سلول های سرطانی هدف مربوطه خود و سلول های NK انسانی متصل می شوند. سلول های NK در حضور سلول های سرطانی هدف فعال شدند.
آنها سپس سمیت سلولی NKeND ها را با تنظیم نسبت سلول های NK به سلول های سرطانی (نسبت N:C) ارزیابی کردند. مشخص شد که میزان سمیت سلولی با واسطه سلولهای NK در برابر سلولهای سرطانی هدف نه تنها به تعداد سلولهای NK بلکه به غلظت هر دو NKeND بستگی دارد، آنهایی که HER2 (HER2@NKeND) و آنهایی که EGFR (EFGR) را نشان میدهند. @NKeND). سلول های عادی و غیر هدفمند بدون توجه به تعداد سلول های NK اعمال شده، سمیت سلولی با واسطه سلول های NK را نشان ندادند. محققان می گویند این یافته ها نشان می دهد که سمیت با واسطه سلول NK در درجه اول به تعامل مستقیم بین سلول های NK و سلول های سرطانی هدف با واسطه NKeND ها نسبت داده می شود.
به موشهای حامل تومور SK-OV-3 تزریق داخل وریدی HER2@NKeND به همراه سلولهای تک هستهای خون محیطی انسان (PBMCs) داده شد، که هر سلول خونی با هسته گرد، از جمله سلولهای NK است. محققان به این نتیجه رسیدند که در حالی که تجویز HER2@NKeND به تنهایی رشد تومور را سرکوب نمی کند، تجویز همزمان PBMCs و HER2@NKeND این کار را انجام میدهد که نشان می دهد وجود PBMCs برای سرکوب موثر ضروری است. هنگامی که محققان این حیوانات را از نظر بافت شناسی تجزیه و تحلیل کردند، به این نتیجه رسیدند که این ترکیب باعث مرگ سلولی خاص در تومور هدف می شود که منجر به سرکوب قابل توجهی بدون آسیب خارج از هدف به اندام های اصلی می شود.
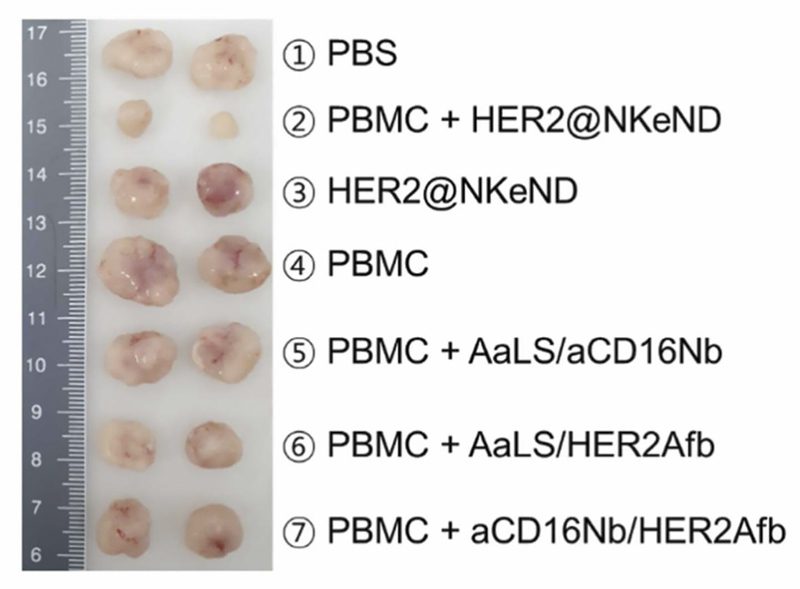
هنگامی که سلول های NK از PBMC ها استخراج شدند و همراه با HER2@NKeND تزریق شدند، رشد تومور تا حد زیادی سرکوب شد و تعداد لکوسیت های انسانی (گلبول های سفید خون) و سلول های NK به طور قابل توجهی افزایش یافت. با این حال، توانایی سرکوب تومور نسبتاً کمتر از زمانی بود که از PBMC های کل انسان استفاده می شد. محققان این موضوع را به عدم وجود سایر سلولهای ایمنی مانند سلولهای T و مواد تکمیلی که از فعالیت سیتوتوکسیک سلولهای NK پشتیبانی میکنند، نسبت میدهند.
محققان گفتند: HER2@NKeND به طور خاص سلولهای NK را به محل تومور جذب میکند و منجر به سرکوب رشد تومور میشود. اثربخشی سرکوب تومور توسط HER2@NKeND به حضور و نفوذ سلولهای NK انسانی متکی است که متعاقباً باعث نفوذ بیشتر سلولهای T انسانی میشود. فعل و انفعال بین این سلول های T و سلول های NK ممکن است به سرکوب موثر رشد تومور کمک کند. البته مطالعات بیشتری برای روشن شدن مکانیسم های اساسی با جزئیات بیشتر مورد نیاز است.
محققان می گویند که مطالعه آنها دری را برای توسعه درمان های جدید مخصوص سرطان باز می کند.
آنها گفتند: NKeND های تازه توسعه یافته برای هدف قرار دادن سرطان (HER2@NKeND و EGFR@NKeND) دارای پتانسیلی به عنوان ایمونوتراپی سرطان مبتنی بر پروتئین برای درمان انتخابی تومورهای هدف هستند. استراتژی ما این امکان را دارد که برای درمان انواع مختلف سرطان با تغییر لیگاندهای هدفگیرنده سرطان و سلولهای ایمنی، گسترش یابد و در نتیجه فرصتهای جدیدی برای پیشرفت درگیرکنندههای سلول NK نوترکیب ارائه شود.