فهرست مطالب
شواهد زیادی وجود دارد که نشان می دهد آهن موجود در مغز ممکن است در بروز و ابتلا به بیماری آلزایمر نقش داشته باشد.
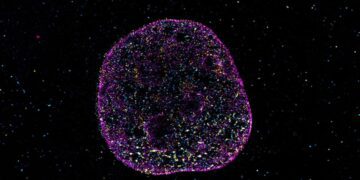
به گزارش تکناک، با توجه به این ایده، نتایج یک تصویربرداری جدید از مغز برای اولین بار نشان داده است که در همان مناطقی از مغز که پلاک های بتا آمیلوئید مرتبط با آلزایمر در آن رخ می دهد، افزایش ردوکس آهن نیز وجود دارد. این بدان معنی است که آهنی که در این مناطق وجود دارد در حضور اکسیژن واکنش پذیرتر است.
تیمی از دانشگاه تگزاس در آستین و دانشگاه ایلینویز در Urbana-Champaign مطالعه ای را در مورد تکنیک و یافته های جدید تصویربرداری در مجله Science Advances منتشر کردند.
یی لو، نویسنده مسئول و استاد شیمی در دانشگاه UT آستین گفت: ارتباط بین ردوکس آهن و بیماری آلزایمر یک جعبه سیاه بوده است. هیجانانگیزترین بخش برای من این است که ما اکنون راهی برای تابش نور به این جعبه سیاه داریم تا بتوانیم کل این فرآیند را با جزئیات بیشتری درک کنیم.
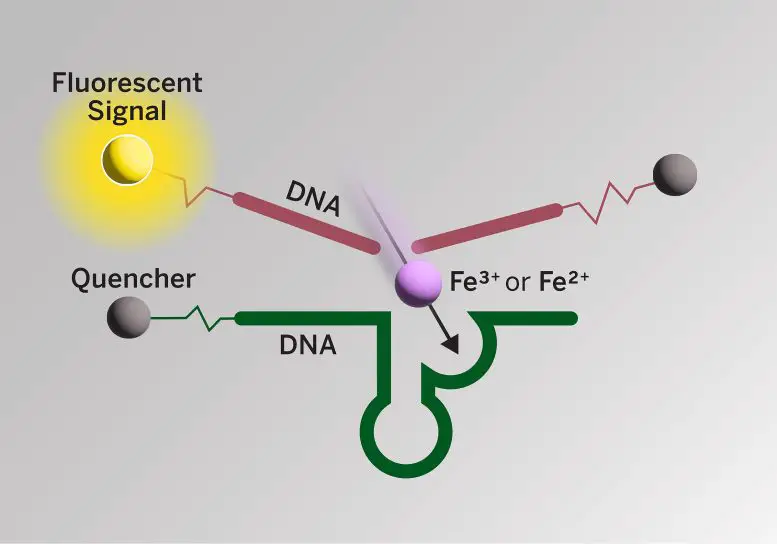
حدود یک دهه پیش، دانشمندان فروپتوز، فرآیندی در بدن که وابسته به سطوح بالای آهن است و منجر به مرگ سلولی میشود، همچنین نقش کلیدی در بیماریهای تخریبکننده عصبی، مانند آلزایمر دارد را کشف کردند. دانشمندان با استفاده از تصویربرداری تشدید مغناطیسی بر روی بیماران الزایمری زنده، دریافتهاند که این بیماران تمایل به افزایش سطح آهن در مغز دارند، اگرچه این روش بین اشکال مختلف آهن تفاوتی قائل نمیشود. این یافته ها روی هم نشان می دهد که آهن ممکن است در تخریب سلول های مغز در بیماران آلزایمر نقش داشته باشد.
برای مطالعه جدید، محققان حسگرهای فلورسنت مبتنی بر DNA را توسعه دادند که میتواند دو شکل مختلف آهن (Fe2+ و Fe3+) را به طور همزمان در کشتهای سلولی و در برشهای مغز موشهایی که از نظر ژنتیکی برای شبیه سازی بیماری الزایمر اصلاح شدهاند، شناسایی کند. این اولین تکنیک تصویربرداری است که میتواند به طور همزمان هر دو شکل آهن را در سلولها و بافتها تشخیص دهد و در عین حال کمیت و توزیع فضایی آنها را نیز نشان دهد.
یوتینگ وو، نویسنده اول این مطالعه و محقق فوق دکترا در آزمایشگاه لو در UT آستین گفت: بهترین بخش در مورد حسگر ما این است که اکنون میتوانیم تغییرات Fe2+ و Fe3+ و نسبتهای آنها را در هر مکان تجسم کنیم. ما میتوانیم هر بار یک پارامتر را تغییر دهیم تا ببینیم که آیا پلاکها یا حالتهای اکسیداتیو آهن را تغییر میدهد.

این توانایی می تواند به آنها کمک کند تا بهتر درک کنند که چرا افزایش نسبت Fe3+ به Fe2+ در محل پلاک های آمیلوئید بتا وجود دارد و اینکه آیا افزایش ردوکس آهن در تشکیل پلاک ها نقش دارد یا خیر؟
01
از 01نقش آهن در مرگ سلولی
سوال کلیدی دیگر این است که آیا ردوکس آهن به طور مستقیم در مرگ سلولی در آلزایمر نقش دارد یا صرفاً یک محصول جانبی است. محققان قصد دارند این سوال را در موش های آلزایمری بررسی کنند. اگر تحقیقات بیشتر مشخص کند که آهن و تغییرات ردوکس آن واقعاً باعث مرگ سلولی در بیماران مبتلا به آلزایمر می شود، این اطلاعات می تواند یک استراتژی جدید بالقوه برای توسعه دارو ارائه دهد. به عبارت دیگر، شاید دارویی که نسبت Fe3+ به Fe2+ را تغییر دهد میتواند به محافظت از سلولهای مغز کمک کند. تکنیک تصویربرداری جدید میتواند برای درک این موضوع که کدامیک از کاندیدهای دارویی در تغییر نسبت بهتر عمل می کنند مورد استفاده قرار گیرد.
برای توسعه حسگرها، دانشمندان ابتدا یک آزمایشگاه تجاری را استخدام کردند تا مجموعه ای از 100 تریلیون رشته کوتاه DNA را از طریق یک فرآیند شیمیایی به نام سنتز الیگونوکلئوتید تولید کند. آنها سپس یک فرآیند غربالگری را برای یافتن رشتههایی انجام دادند که شکل خاصی از آهن را تشخیص میدهند یا در اصطلاح شیمی به شدت به آن متصل میشوند و یک واکنش کاتالیزوری با آن انجام میدهند. برای تکمیل حسگرها، اجزای دیگری از جمله مولکولهایی به نام فلوروفور اضافه شدند که زمانی که پویشگر شکل خاص آهن را تشخیص میدهد، به رنگ خاصی میدرخشند.