محققان اخیرا یک روش جدید و غیرتهاجمی برای انتقال فناوری ویرایش ژن به مغز برای از بین بردن اضطراب میشود، ایجاد کردهاند.
به گزارش تکناک، اگرچه این تکنیک تاکنون فقط بر روی موش ها استفاده شده است، اما یافته های جدید راه را برای توسعه روش های درمانی جدید، به ویژه برای افرادی که به دارو مقاوم هستند، باز می کند.
سلامت روان بخش مهمی از زندگی ماست. سلامت روانی ضعیف بر رفاه، توانایی کار، و روابط با خانواده، دوستان و جامعه به طور گسترده تر تأثیر میگذارد. اختلالات اضطرابی از جمله اختلال اضطراب فراگیر، اختلال هراس و اختلال اضطراب اجتماعی که با ترس و نگرانی بیش از حد مشخص می شوند، به اندازه شدید هستند که باعث ناراحتی قابل توجهی در فرد یا اختلال در عملکرد او می شوند.
بر اساس گزارش سازمان بهداشت جهانی (WHO)، در سال 2019، 301 میلیون نفر در سراسر جهان با یک اختلال اضطرابی زندگی می کردند که 58 میلیون نفر از آنها کودک و نوجوان بودند. همچنین این سازمان به افزایش 25 درصدی شیوع اضطراب با شروع همه گیری کووید 19 اشاره کرد. اگرچه اضطراب معمولاً با داروهای روزانه درمان میشود، اما داروها میتوانند عوارض جانبی داشته باشند و حتی برای برخی از بیماران حتی موثر هم نیستند.
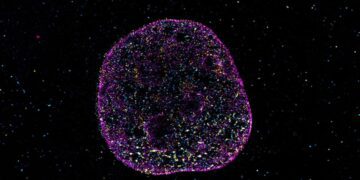
اکنون محققان یک روش غیرتهاجمی برای ارائه فناوری ویرایش ژن CRISPR/Cas9 به مغز ایجاد کردهاند تا ژن مرتبط با اضطراب و افسردگی در موشها را از بین ببرد. آنها می گویند این اولین آزمایش موفقیت آمیز تحویل غیر تهاجمی CRISPR/Cas9 است که قادر به عبور از سد خونی مغزی برای فعال کردن تغییرات ژنتیکی و از بین بردن اضطراب است.
سد خونی مغزی (BBB) همانطور که از نامش پیداست، یک سد ساختاری و عملکردی است که مانع از ورود مواد مضر مانند باکتری ها و ویروس ها به مغز از طریق خون می شود، البته این سد اجازه ورود مواد مغذی ضروری را می دهد. اگرچه این امر برای حفظ سلامتی ما بسیار مفید است، اما این سد به قدری قوی است که حتی می تواند از دسترسی عوامل درمانی به مغز نیز جلوگیری کند.
ویرایش دقیق ژن با استفاده از روش CRISPR/Cas9 پتانسیل زیادی برای درمان بیماری های مختلف از جمله دیستروفی عضلانی، HIV و سرطان ریه دارد. سیستم CRISPR از آنزیمی (Cas9) استفاده میکند که با هدایت یک RNA راهنما (gRNA)، بخش خاصی از DNA را برش میدهد. این RNA میتواند ژنهای مشکلساز مانند ژنهایی که باعث بیماری میشوند را حذف کند. اما مانند سایر عوامل درمانی، سد خونی مغزی چالشی را برای سیستم CRISPR ایجاد می کند.
در مطالعه حاضر، محققان تحویل داخل بینی سیستم CRISPR/Cas9 را آزمایش کردند تا ببینند آیا این سیستم با موفقیت از سد خونی مغزی عبور می کند و ژن گیرنده سروتونین (HTR2A) را که در دسترس بودن سروتونین را تعدیل می کند، از بین می برد. این انتقال دهنده عصبی وظایف بسیاری از جمله تنظیم خلق و خو را انجام می دهد. میزان بسیار کم سروتونین، در اضطراب و افسردگی نقش دارد، به همین دلیل است که برای افراد مبتلا به این شرایط، اغلب مهارکننده های انتخابی بازجذب سروتونین (SSRIs) تجویز می شود که باعث افزایش میزان سروتونین در مغز می شوند.
عوامل درمانی که از راه بینی وارد بدن می شوند، از طریق مسیرهای عصبی داخل حفره بینی به سیستم عصبی مرکزی می رسند. این روش نه تنها یک روش عملی است، بلکه غیرتهاجمی نیز هست.
پژوهشگران برای انتقال gRNA به نورونهای مغز، یک ناقل ویروسی غیرفعال از نوع adeno-associated virus (AAV) را به بینی موشها تزریق کردند تا به ژن هدف HTR2A متصل شود و سپس Cas9 آن را برش دهد. AAVs به عنوان ناقل های معمول در روش CRISPR/Cas9 برای انتقال استفاده میشوند زیرا ایمن تر هستند و احتمال کمتری دارد که پاسخ ایمنی شدیدی ایجاد کنند. پژوهشگران در این تحقیق از نوع AAV9 استفاده کردهاند که یک ناقل فوق العاده کارآمد برای انتقال به نورونهای سیناپس مغز در سراسر سیستم عصبی مرکزی است.
پنج هفته پس از اجرای ویرایش ژن، اضطراب موشها با استفاده از آزمون رفتاری تاریکی به روشنی و آزمایش دفن سنگ مرمر مورد آزمایش قرار گرفت. در آزمایش تاریکی به روشنی، به موش ها برای کاوش در یک محفظه با نور روشن یا یک اتاق تاریک حق انتخاب داده می شود. موش های مضطرب تمایل داشتند زمان بیشتری را در اتاق تاریک بگذرانند. در آزمایش دفن سنگ مرمر، تیلههای شیشهای به صورت شبکهای در خاک اره قرار میگیرند و به موشها اجازه داده میشود تا برای مدت مشخصی در قفس کاوش کنند. موش های مضطرب تیله های بیشتری را دفن خواهند کرد.
محققان در این تحقیق کاهش 8.47 برابری در فعالیت HTR2A را در موش های تحت درمان مشاهده کردند. با توجه به آزمایش دفن سنگ مرمر، این موش ها 14.8 درصد کاهش در تعداد تیله های دفن شده در مقایسه با گروه تحت کنترل از خود نشان دادند. برای آزمایش تاریکی به روشنی، موشهای تحت درمان زمان قابل توجهی بیشتری را در جعبه روشن سپری کردند (35.7 درصد افزایش) و موش های بیشتری به جعبه روشن ورود داشتند (27.5 درصد افزایش). این نتایج با موشهای تحت درمان با بنزودیازپین دیازپام قابل مقایسه بود که مدت زمان ماندن آنها در جعبه روشن 40 درصد بود و باعث شد محققان به این نتیجه برسند که درمان هدفگیری ژن HTR2A آنها همتراز با دارو بوده است.
محققان میگویند: نتایج ما نشان میدهد که حتی با درصد کم ویرایش ژن عصبی، اثرات قابلتوجهی در کاهش اضطراب مشاهده میشود.
محققان می گویند که مطالعه مفهومی آنها نشان می دهد که ویژگی های خاص را می توان در طولانی مدت اصلاح کرد، که این مسئله پیامدهای مهمی برای توسعه داروهای جدید برای درمان اضطراب و افسردگی، به ویژه برای کسانی که به داروها مقاوم هستند، دارد.