بهلطف روشی جدید، میتوان بافت آسیب دیده مغز را دوباره رشد داد. این روش به محققان اجازه میدهد سلولهای بنیادی را دقیقاً به نوع سلولهای مغزی که برای یک نقطه خاص نیاز دارند، هدایت کنند.
به گزارش تکناک، محققان با استفاده از این روش، درمانهای جدیدی را برای سکته مغزی، آسیب مغزی تروماتیک و اماس هدف قرار دادهاند.
مغز و نخاع ظرفیت محدودی برای بازسازی پس از آسیب دارند. به دنبال آسیب اولیه ناشی از سکته مغزی، آسیب مغزی تروماتیک یا آسیب نخاعی، التهاب و تشکیل بافت اسکار باعث آسیب بافت ثانویه میشود که به سختی بهبود مییابد.
ترمیم آسیب مغزی با استفاده از سلولهای بنیادی یا پیشساز عصبی که میتوانند خود ترمیمی کنند و به سلولهای مغزی خاص مانند سلولهای عصبی و گلیال تمایز یابند، نویدبخش است. با این حال، سلولهای بنیادی باید در محیطی به بافت تحویل داده شوند که بقا و رشد بعدی آنها را تضمین کند.
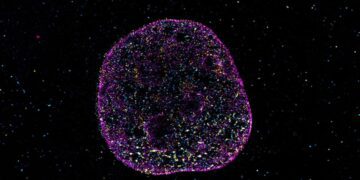
محققان دانشگاه روهر بوخوم و دانشگاه دورتموند در آلمان یک محیط هیدروژلی با بار مثبت ایجاد کردهاند که تمایز سلولهای بنیادی عصبی به سلولهای خاصی را هدایت میکند که میتواند به بازسازی بافت آسیب دیده مغز کمک کند.
کریستین گلوتزباخ، نویسنده ارشد این مطالعه گفت: هدف ما ایجاد یک محیط مصنوعی برای سلولها بود که محیط سلولی طبیعی مغز را تقلید کند. سلولها دارای یک پوشش با بار منفی هستند که به آن ماتریکس دور سلولی نیز میگویند. این بدان معنی است که آنها به خوبی به بسترهای دارای بار مثبت میچسبند.
سلولهای بنیادی عصبی میتوانند به سه نوع سلول متمایز شوند: نورونها، آستروسیتها و الیگودندروسیتها. نورونها واحدهای بنیادی مغز و سیستم عصبی هستند که مسئول دریافت ورودی حسی از دنیای بیرون، ارسال دستورات حرکتی به ماهیچهها و تبدیل و انتقال سیگنالهای الکتریکی در هر مرحله میباشند. آستروسیتها و الیگودندروسیتها زیرگروههای سلولهای گلیال هستند که از نورونها پشتیبانی، اتصال و محافظت میکنند.
استفاده از هیدروژلها به عنوان واسطه برای سلولهای بنیادی چیز جدیدی نیست، اما تاکنون تعداد کمی از محققان از هیدروژلهای با بار مثبت یا کاتیونی استفاده کردهاند. بنابراین برای مطالعه فعلی، محققان به سنتز یکی از آنها پرداختند. مولکول اصلی مولکول کاتیونی trimethylaminoethyl acrylate (TMAEA) بود. با استفاده از این مولکول، محققان شش ژل (G1 تا G6) با افزایش غلظت بار کاتیونی ایجاد کردند. G1 شارژ نشد و به عنوان یک ژل مرجع خنثی عمل کرد.
محققان با استفاده از سلولهای بنیادی و پیشساز عصبی (NSPC) از مغز جنینی موش، 40000 سلول را در هر یک از شش هیدروژل قرار دادند. آنها به این نتیجه رسیدند که بار کاتیونی ژل تأثیر زیادی بر تمایز سلولها دارد. G5 که دومین هیدروژل با بار مثبت است، نورونهای بیشتری نسبت به G1 بدون بار داشت. در مقابل، هیدروژلهای G2 و G3 با شارژ پایینتر، آستروسیتهای بیشتری نسبت به G6 با شارژ بالا داشتند. بیشترین تعداد الیگودندروسیت در G1، G3 و G4 و کمترین در G6 یافت شد، اما در مجموع، درصد الیگودندروسیت در مقایسه با نورونها و آستروسیتها بهطور قابل توجهی کمتر بود. روی هم رفته، تمایز سلولی هیدروژلهای G1 تا G6 نشان داد که هر نوع سلول بهترین واکنش را به غلظت بار کاتیونی خاص نشان میدهد.
در حالی که NPSCها روی هیدروژلهای کاتیونی زنده ماندند، محققان کشف کردند که افزودن فاکتور رشد فیبروبلاست 2 (FGF2) که بسیاری از عملکردهای سلولی از جمله تکثیر و تمایز سلولی را در بدن تنظیم میکند، بقای سلولها و سرعت تقسیم را افزایش میدهد.
به گفته محققان، توانایی هدایت سلولهای بنیادی برای تمایز به سلولهای مغزی خاص، مزایایی دارد.
گلوتزباخ گفت: بسته به آسیب، انواع سلولهای مختلف باید جایگزین شوند. در برخی بیماریها، سلولهای گلیال نیز مورد حمله قرار میگیرند که باید جایگزین شوند. به عنوان مثال، در بیماری اماس، عایق سلولهای عصبی که توسط الیگودندروسیتها تشکیل میشود، از بین میرود.
محققان قصد دارند به تنظیم دقیق هیدروژل خود ادامه دهند، از جمله ساخت ژلی که میتواند برای پر کردن حفرههای بافت مغز پس از آسیب استفاده شود.
گلوتزباخ میگوید: در مطالعات آینده، مایلیم ژلهای دارای بار مثبت را به پپتیدها یا اجزای مولکولهای ماتریکس خارج سلولی مجهز کنیم و در نتیجه محیط طبیعی سلولها را حتی بهتر تحریک کنیم.
این مطالعه در مجله ACS Biomaterials Science منتشر شد.