فهرست مطالب
دانشمندان در دانشگاه راکفلر، کشف جدیدی در مورد ویروس هپاتیت B انجام دادهاند که میتواند باعث ایجاد درمانهای نوین شود.
به گزارش تکناک، آنها مکانیزمهای جدیدی از پروتئین پلیمراز ویروس را آشکار کردهاند که این پروتئین برای تکثیر ویروس ضروری است.
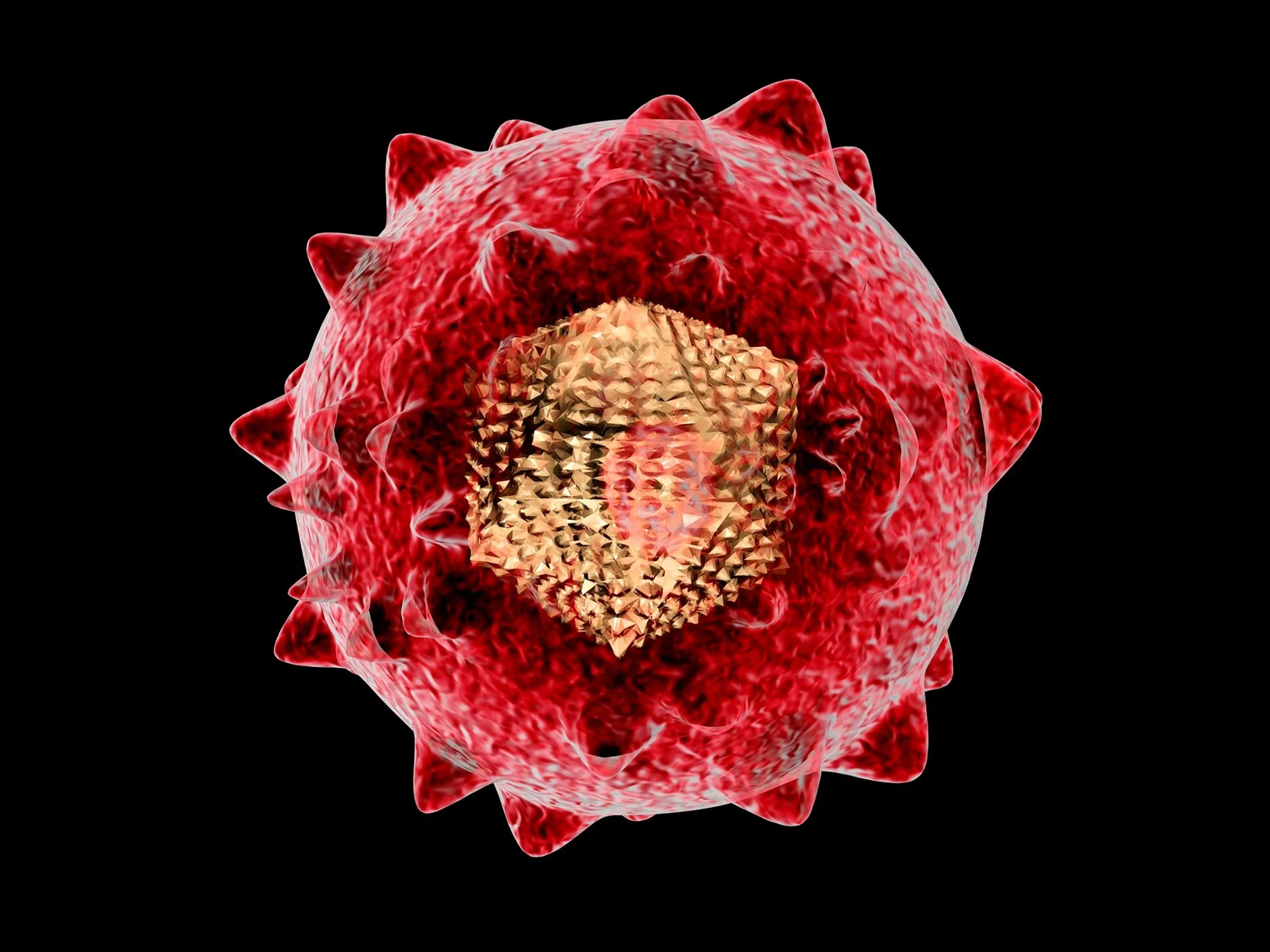
ویروس هپاتیت B (HBV) کوچک، خطرناک و بسیار مسری است. این بیماری تاکنون بهطور مزمن حدود 296 میلیون نفر را مبتلا کرده است و سالانه حدود 1 میلیون نفر را نیز قربانی میکند. این ویروس گریزان، کبد را هدف قرار میدهد و اغلب تا زمانی که باعث سیروز یا سرطان شود بدون علامت باقی میماند.
اکثر درمانها سعی میکنند تا پروتئین پلیمراز (pol) ویروس را مهار کنند، امّا این درمانها تا مادام العمر باید انجام شوند و بیماری را بهطور کامل درمان و از بین نمیبرند.
اکنون محققان آزمایشگاه چارلز ام رایس راکفلر، مکانیسمهایی را نشان دادهاند که قبلاً دیده نشده بودند و ممکن است به رویکردهای درمانی جدیدی برای HBV منجر شود. آنها نتایج تحقیق خود را در مجلۀ Cell منتشر کردند.
بیل اشنایدر، نویسندۀ ارشد این مقاله گفت: مهارکنندههای فعلی میتوانند عفونت را کاهش دهند، امّا نمیتوانند آن را ریشهکن کنند. علوم پایه میتواند بینش جدیدی ارائه دهد و استراتژیهای متفاوتی را به دنبال داشته باشد. به همین دلیل برای کسب اطلاعات بیشتر در مورد این ویروس ما از ابتدا به بررسی آن پرداختیم.
01
از 03ارگانیسم غیرعادی
ژنوم HBV بهطور غیرعادی محافظه کار است. بیش از نیم این ژنوم، شامل فریمهای خواندنی همپوشانی است و مناطقی هستند که نوکلئوتیدها بیش از یک پروتئین را در آنجا فعال میکنند. از آنجایی که یک جهش منفرد در یکی از این فریمها میتواند باعث تغییر در دیگری شود، ویروس باید کنترل دقیقی بر روی این مناطق به هم پیوسته داشته باشد تا از اثرات فاجعهآمیز جلوگیری کند.
با وجود این، HBV به وضوح به اندازۀ کافی انعطافپذیر است تا با محیطها و میزبانهای جدید سازگار شود. اشنایدر در این زمینه توضیح داد: HBV یک ویروس بسیار موفق در انسان است و سویههای نزدیک آن انواع پرندگان و پستانداران را آلوده میکنند.
اینکه چگونه HBV این تعادل ظریف بین سفتی ژنتیکی و انعطافپذیری را مدیریت میکند، به خوبی درک نشده است، چرا که جدا کردن این فریمهای همپوشانی به دشواری امکانپذیر میباشد. عمل جمعی آنها مکانیسمهای پروتئینهای فردی را پنهان میکند.
مدتهاست که در رادار محققان، پروتئین pol وجود دارد، که نقش اساسی در تکثیر HBV ایفا میکند. پروتئین pol یک مولکول چند منظوره است و اهمیت آن با اندازۀ آن مشخص میشود. این پروتئین بسیار بزرگتر از سایر پروتئینهای ویروسی است و دو سوم ژنوم دایرهای HBV را میپوشاند و یکی از فریمهای خواندن همپوشانی را با سه پروتئین دیگر به اشتراک میگذارد.
برای درک بهتر اجزای دینامیک آن، محققان دانشگاه رایس از رویکرد جدیدی استفاده کردند و آن را سال گذشته توسعه دادند، که در آن RNA را به سلولهای کشت داده شده برای تولید DNA ویروسی، پروتئینها و سایر محصولات میرساند. این رویکرد به آنها اجازه میدهد تا عملکرد پروتئینها را در فریمهای خواندنی که روی هم قرار گرفتهاند، جدا کنند و دید واضحتری از pol به دست آورند.
دو ورق کاغذ شفاف با متنهای مختلف را تصور کنید که بر روی هم چیده شدهاند. اشنایدر دربارۀ آن گفت: اگر بتوانید یکی از برگهها را بردارید، خواندن آن آسانتر خواهد بود. این همان چیزی است که این سیستم تحویل RNA به ما اجازه میدهد تا انجام دهیم.
در مرحلۀ بعد، آنها از اسکن جهشی عمیق استفاده کردند، که روشی با توان عملیاتی بالا است و میتواند مکانیک و رفتار دهها هزار نوع پروتئین را آشکار کند و محققان را قادر میسازد تقریباً هر گونۀ ممکن در پروتئین pol را آزمایش کنند و ببینند که چگونه به هر تغییر پاسخ میدهند.
02
از 03ریبوزومهای متوقف شده
یکی از اولین اکتشافات غیرمنتظرۀ آنها، نیاز شدید به اسیدهای آمینه به نام پرولین در نزدیکی انتهای پروتئین pol بود. این مولکولهای سفت و سخت به کاهش سرعت ریبوزومها که ماشینهای مولکولی هستند و با حرکت در طول یک مولکول RNA پیامرسان و تبدیل کد به زنجیرهای از اسیدهای آمینه، پروتئینها را میسازند، شناخته شدهاند.
چندین پرولین پشت سر هم میتوانند یک ریبوزوم را در مسیر خود متوقف کنند. هنگامی که یک ریبوزوم در یک نقطۀ خاص کد متوقف میشود، بهطور موقت حرکت انتقالی را مسدود میکند.
محققان به این نتیجه رسیدند که ریبوزومهایی که پروتئین pol را میسازند، درست قبل از پایان کار متوقف میشوند و پروتئین را مانند بادکنکی که به دست کودک بسته شده است، به ریبوزوم متصل میکنند.
دانشمندان میگویند که به نظر میرسد این توقف ممکن است به پروتئین زمان دهد که به درستی تا شود و کار خود را انجام دهد و مهمتر از همه، احتمال اتصال آن به RNA صحیح را افزایش میدهد. RNA صحیح RNAی است که آن را رمزگذاری کرده است. تنها در این صورت خواهد بود که پروتئین آزاد شود.
03
از 03هدفگذاری برای اهداف جدید
پروتئین pol ترجیح میدهد RNAی را که از آن سرچشمه گرفته است (معروف به cis-preference) را رونویسی معکوس کند تا اینکه RNA دیگری را برای کپی بیابد، امّا چگونگی دستیابی به آن از طریق توقف ریبوزوم تاکنون ناشناخته بود.
این فرآیند ممکن است راهی برای پروتئین pol باشد تا فقط RNAهای اثبات شده را منتشر کند.
اشنایدر با بیان اینکه پروتئینهای pol زیادی ساخته نمیشوند، عنوان کرد: بنابراین ویروس میخواهد مطمئن شود که وقتی یکی ساخته میشود، قطعاً میتواند کار خود را درست انجام دهد. Cis preference توسط مکانیسم اتصال به احتمال زیاد کمک میکند تا مطمئن شود که پروتئین فقط در سلول به دنبال RNA همزاد خود شناور نیست. این یک فرآیند کارآمدتر است.
در مرحلۀ بعدی تحقیق، محققان چگونگی دستکاری اولویت cis pol را بررسی خواهند کرد. اشنایدر در این باره بیان کرد: وقتی مکانیزمی را درک کردید، میتوانید آن را مختل کنید و بفهمید که چه عواقبی دارد.
وی اعلام کرد: یک نظریه این است که با جهش دادن پرولینهایی که باعث ایجاد مکث میشوند، از توقف ریبوزوم جلوگیری کنیم. این کار به احتمال زیاد ویروس را مهار میکند و ممکن است ایجاد مقاومت دارویی برای ویروس را دشوارتر کند.