بر اساس مطالعه جدیدی که در مجله تحقیقات اسیدهای نوکلئیک منتشر شده است، محققان شناسایی کرده اند که فرایند ترمیم دیانای (DNA )انسان در سطح مولکولی کنترل می شود.
به گزارش تک ناک، این کشف می تواند راه را برای توسعه داروهای درمانی جدید برای افزایش اثربخشی پرتودرمانی در بیماران سرطانی هموار کند.
DNA انسان
DNA در هر سلول انسانی به اندازه حدود سه میلیارد رقم طول دارد و هر بار که یک سلول تقسیم می شود DNA باید کپی شود که تقریباً دو تریلیون بار در روز اتفاق می افتد. این فرآیند به شدت تنظیم شده است تا از هرگونه جهش تکراری جلوگیری شود. با این حال، DNA در سلول ها به طور مداوم در معرض عوامل آسیب زای درونی و بیرونی، مانند گونه های فعال اکسیژن و تابش UV قرار می گیرد.
برای کاهش پیامدهای بیولوژیکی آسیب DNA، همه موجودات زنده مکانیسم هایی را برای تحمل و ترمیم آسیب DNA ایجاد کرده اند تا اطمینان حاصل شود که اطلاعات ژنتیکی به طور دقیق به ارث می رسد.
یکی از این مسیرهای ترمیم DNA، ترمیم برش نوکلئوتیدی (NER) است که توسط پستانداران برای حذف ضایعات DNA حجیم، مانند ضایعات ایجاد شده توسط اشعه ماوراء بنفش، جهش زاهای محیطی و برخی ترکیبات شیمیایی سرطان زا استفاده می شود.
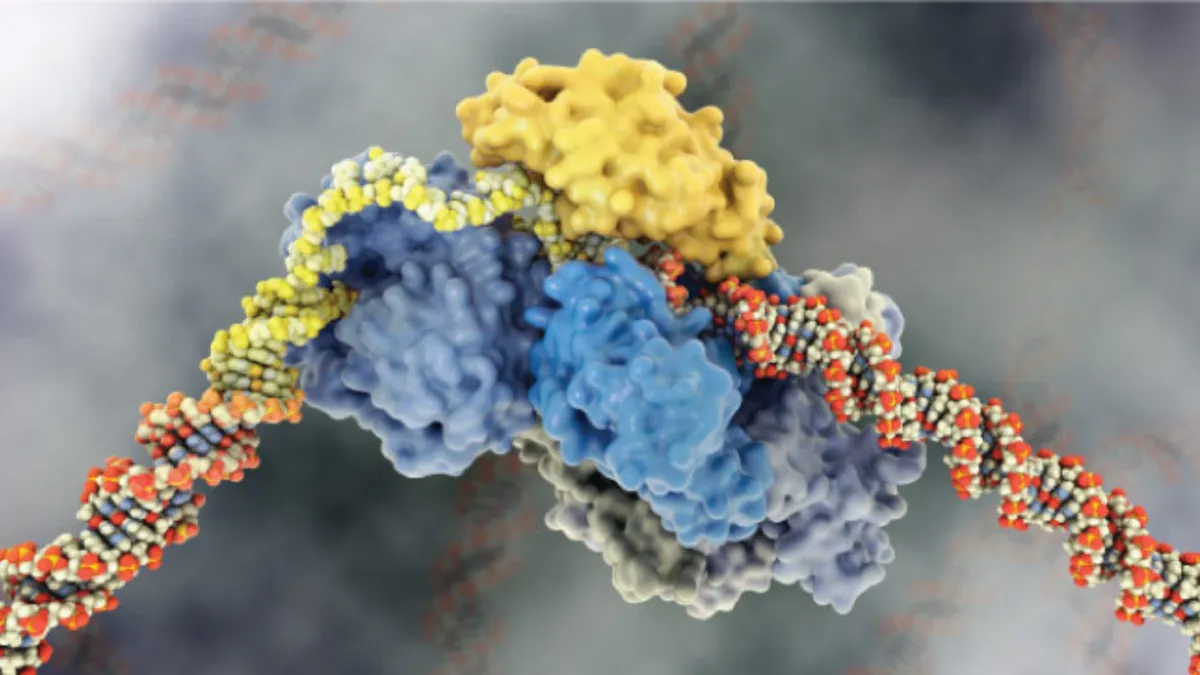
مکانیسم ترمیم DNA
فرایند NER به شدت منظم است و در چهار مرحله اصلی رخ می دهد: (1) تشخیص آسیب DNA، (2) باز کردن رشته DNA توسط موتور مولکولی TFIIH و برداشتن حدود 30 نوکلئوتید توسط هسته های XPG و XPF برای حذف آسیب، (3) سنتز DNA پرکننده شکاف و (4) بستن انتهای باز DNA.
اگرچه محققان بازیگران پیشرو در فرآیند NER را میشناختند، اما نحوه هماهنگی و تنظیم این مراحل به خوبی درک نشده بود.
اکنون یک تیم بین المللی به سرپرستی محققان دانشگاه علم و صنعت ملک عبدالله (KAUST) و مرکز سرطان اندرسون دانشگاه تگزاس نشان داده اند که چگونه مکانیسم NER در سطح مولکولی کنترل می شود و برای درمان سرطان پتانسیل بالایی دارد.
دکتر عامر برالیک نویسنده مسئول میگوید: در طول پرتودرمانی، سلولهای سرطانی با اشعه منفجر میشوند تا تومورها را کوچک کنند. با این حال، در این شرایط، NER بر خلاف درمان عمل میکند و سعی میکند آسیب را ترمیم کند و از مرگ سلولی جلوگیری کند، که به طور قابل توجهی اثربخشی درمان را کاهش میدهد.
طراحی مهارکننده های NER به عنوان داروهای موثر
یک مانع مهم در طراحی بازدارنده ها، فقدان دانش اولیه در مورد مکانیسم NER است. گروه پروفسور سمیر حمدان در KAUST کشف کرده اند که چگونه TFIIH از XPG برای تحریک فعالیت حرکتی خود برای یافتن DNA آسیب دیده استفاده می کند. هنگامی که TFIIH آسیب را شناسایی می کند، به فعالیت هسته XPG سیگنال می دهد تا آن را حذف کند.
پروفسور سمیر حمدان می گوید: این یافته ها یک مکانیسم کنترل اساسی را در NER آشکار کرد و برای مقابله با تعامل بین TFIIH و XPG به عنوان یک هدف دارویی موثر دلیل می آورد.
درک بهتر مکانیسم های درگیر در ترمیم DNA راه را برای توسعه مهارکننده های NER برای بهبود اثربخشی پرتودرمانی هموار می کند.
جهش در پروتئین های دخیل در مکانیسم NER واسطه بیش از ده بیماری بالینی است. جهش در یکی از این پروتئین ها ممکن است باعث چندین بیماری شود و ترکیبات مختلف جهش پروتئین ممکن است باعث یک بیماری شود. برالیک توضیح میدهد: یافتههای ما دیدگاههای جدیدی را در رابطه با ارتباط اطلاعات سطح مولکولی با وضعیتهای بیماری ارائه میکند.
حمدان در پایان میگوید: از طریق برنامه سلامتی هوشمند مبتکرانه دانشگاه KAUST، ما با پزشکان در عربستان برای مطالعه چشمانداز بالینی پروتئینهای NER در بیماران کار خواهیم کرد.